题目内容
【题目】Fe3O4和CuO的固体混合粉末40g,高温下用C还原充分反应(假设生成的气体全部为二氧化碳),得到金属混合物为Wg,将生成的CO2气体用足量的澄清石灰水吸收后,产生30g白色沉淀,则W的值为( )
A.30.4g
B.28 g
C.35.6g
D.29.8g
【答案】A
【解析】解:设生成的二氧化碳的质量为x
CO2+Ca(OH)2═ | CaCO3↓+H2O |
44 | 100 |
X | 30g |
![]() =
= ![]() ,x=13.2g.
,x=13.2g.
二氧化碳中氧元素的质量等于金属氧化物中氧元素的质量,故金属混合物的质量:40g﹣13.2g× ![]() =30.4g.
=30.4g.
故选A.
【考点精析】根据题目的已知条件,利用质量守恒定律及其应用的相关知识可以得到问题的答案,需要掌握①质量守恒定律只适用于化学变化,不适用于物理变化;②不参加反应的物质质量及不是生成物的物质质量不能计入“总和”中;③要考虑空气中的物质是否参加反应或物质(如气体)有无遗漏.

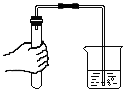
【题目】根据如图所示装置回答问题:
(1)写出下列仪器的名称:①② .
(2)实验室若用B装置来制取二氧化碳,应往长颈漏斗中入 , 若用G装置来收集二氧化碳,二氧化碳应从进入(选“a”或“b”).如果选择装置C制取二氧化碳,与B装置相比,其优点是: .
(3)用不加催化剂的方法制取氧气,选择的发生装置是 , 反应的化学方程式;若选择G装置(事先装满水)收集氧气,则氧气应从通入(选“a”或“b”).
(4)某化学兴趣小组欲测定一块石灰石样品中碳酸钙的质量分数(假设样品中的杂质不溶于水也不与盐酸反应).将15.0g石灰石样品放入烧杯中,再取100g稀盐酸分4次加入烧杯中,每次均充分反应.实验数据记录如下:
次 数 | 第1次 | 第2次 | 第3次 | 第4次 |
加入稀盐酸质量/g | 25 | 25 | 25 | 25 |
反应后烧杯中物质的总质量/g | m | 61.4 | 85.6 | 110.6 |
试计算:
①生成二氧化碳的总质量 g
②第1次加入稀盐酸充分反应后,烧杯中物质的总质量m为
(5)③该石灰石样品中碳酸钙的质量分数(写出计算过程).