题目内容
如图是氧化沉淀法生产复印用高档Fe3O4粉的工艺流程简图,根据要求回答问题.
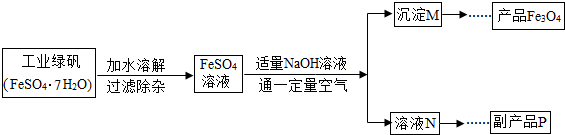
(1)铁的另两种常见氧化物的化学式是______、______.
(2)加水溶解过程中,在实验室里通常要使用的玻璃仪器有烧杯和______,操作A的名称是______.
(3)副产品P是______,由溶液N获得该副产品的操作顺序是b→______→______→d.
a.过滤b.加热浓缩c.冷却结晶d.晶体加热至完全失去结晶水
(4)通空气时的化学方程式是4Fe(OH)2+2H2O+O2═4Fe(OH)3,由沉淀M获得Fe3O4的过程中发生的反应为Fe(OH)2+2Fe(OH)3?Fe3O4+4H2O,控制“一定量空气”的目的是______,沉淀M中Fe(OH)2和Fe(OH)3的最佳质量比为______.(相对分子质量:Fe(OH)2-90,Fe(OH)3-107)

(1)铁的另两种常见氧化物的化学式是______、______.
(2)加水溶解过程中,在实验室里通常要使用的玻璃仪器有烧杯和______,操作A的名称是______.
(3)副产品P是______,由溶液N获得该副产品的操作顺序是b→______→______→d.
a.过滤b.加热浓缩c.冷却结晶d.晶体加热至完全失去结晶水
(4)通空气时的化学方程式是4Fe(OH)2+2H2O+O2═4Fe(OH)3,由沉淀M获得Fe3O4的过程中发生的反应为Fe(OH)2+2Fe(OH)3?Fe3O4+4H2O,控制“一定量空气”的目的是______,沉淀M中Fe(OH)2和Fe(OH)3的最佳质量比为______.(相对分子质量:Fe(OH)2-90,Fe(OH)3-107)
(1)铁的常见氧化物有三种:Fe2O3、FeO、Fe3O4;
(2)溶解时烧杯中盛放的是溶液,用玻璃棒搅拌即可,所以还需玻璃棒;由溶液得溶质用蒸发溶剂的方法;
(3)氢氧化钠与硫酸亚铁反应的生成物是氢氧化亚铁与硫酸钠,因为氢氧化亚铁属于另一反应的反应物了所以副产品是硫酸钠;冷却热饱和溶液 的过程是先加热,再降温,析出晶体后过滤再通过加热除去结晶水即可;
(4)通过反应Fe(OH)2+2Fe(OH)3?Fe3O4+4H2O可知Fe(OH)2和Fe(OH)3都是反应物,如果不控制“一定量空气”氧气过多会把氢氧化亚铁全部氧化,就得不到四氧化三铁了;根据方程式计算出Fe(OH)2和Fe(OH)3的相对分子质量比,别忘了前面的系数.
故答案为:(1)Fe2O3、FeO;(2)玻璃棒;蒸发;(3)硫酸钠;c;a;(4)防止氢氧化亚铁全部被氧化为氢氧化铁;45:107.
(2)溶解时烧杯中盛放的是溶液,用玻璃棒搅拌即可,所以还需玻璃棒;由溶液得溶质用蒸发溶剂的方法;
(3)氢氧化钠与硫酸亚铁反应的生成物是氢氧化亚铁与硫酸钠,因为氢氧化亚铁属于另一反应的反应物了所以副产品是硫酸钠;冷却热饱和溶液 的过程是先加热,再降温,析出晶体后过滤再通过加热除去结晶水即可;
(4)通过反应Fe(OH)2+2Fe(OH)3?Fe3O4+4H2O可知Fe(OH)2和Fe(OH)3都是反应物,如果不控制“一定量空气”氧气过多会把氢氧化亚铁全部氧化,就得不到四氧化三铁了;根据方程式计算出Fe(OH)2和Fe(OH)3的相对分子质量比,别忘了前面的系数.
故答案为:(1)Fe2O3、FeO;(2)玻璃棒;蒸发;(3)硫酸钠;c;a;(4)防止氢氧化亚铁全部被氧化为氢氧化铁;45:107.

练习册系列答案
相关题目

 (5)NH3在一定的条件下能跟O2反应,反应过程可用下列示意图表示(注: 表示氮原子,●表示氧原子,0表示氢原子;各物质未配平)。请分析在该反应中参加反应的NH3与O2的分子个数之比为 。
(5)NH3在一定的条件下能跟O2反应,反应过程可用下列示意图表示(注: 表示氮原子,●表示氧原子,0表示氢原子;各物质未配平)。请分析在该反应中参加反应的NH3与O2的分子个数之比为 。