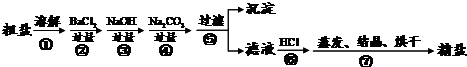
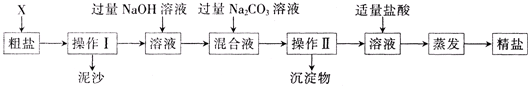
题目内容
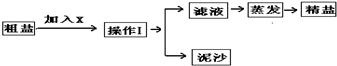
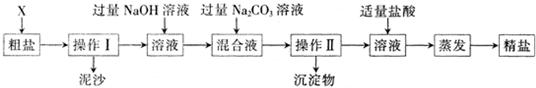
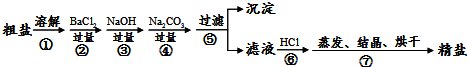
通过海水晾晒可得粗盐和母液,粗盐除NaCl外,还含有CaCl2、Na2SO4以及泥沙等杂质.海水可同时生产氯化钠和金属镁或镁的化合物等产品,其流程如下图所示: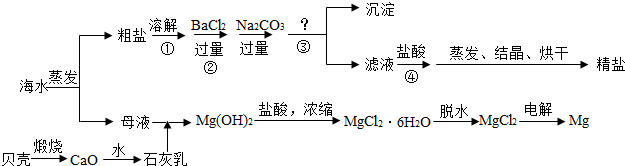
(1)制得粗盐和精盐的操作都包括蒸发步骤,有关其中“蒸发”步骤的叙述错误的是
a.蒸发的目的是得到热饱和溶液b.蒸发的目的是析出晶体
c.应用余热蒸干溶液d.应蒸发至有较多晶体析出时为止
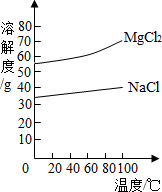
(2)由MgCl2溶液得到MgCl2?6H2O也需要蒸发,根据溶解度曲线,蒸发的目的是
(3)在第①步粗盐溶解操作中要用玻璃棒搅拌,其作用是
(4)该流程的副产品中,除钙元素能被海洋生物利用外,还需综合利用的物质是
(5)MgCl2可电解制Mg,MgO则是重要的耐火材料.
在550℃时,MgCl2?6H2O会分解生成MgO、MgCl2、HCl和水,其中MgO、MgCl2的物质的量之比为3:1,该反应的化学方程式为
(6)电解食盐水所得溶液中的溶质主要为氢氧化钠和氯化钠(其它溶质可忽略不计),已测得该溶液的密度为1.2g/mL,为进一步测定其中氢氧化钠的含量,取该溶液样品25mL与10%的稀硫酸反应,当加入49g稀硫酸时恰好完全中和.请根据化学方程式列式计算:
①25mL该溶液样品中含氢氧化钠多少克?
②该溶液样品中氢氧化钠的质量分数是多少?
分析:(1)制得粗盐和精盐的操作都包括蒸发步骤,有关其中“蒸发”步骤:因为氯化钠的溶解度受温度影响不大,所以b.蒸发的目的是析出晶体,d.应蒸发至有较多晶体析出时为止,反之,则错误;
(2)由MgCl2溶液得到MgCl2?6H2O也需要蒸发,根据溶解度曲线,蒸发的目的是得到热饱和溶液;
(3)①玻璃棒的作用;②钡离子除掉硫酸根;③盐酸除掉过多的碳酸钠;
(4)该流程的副产品中,除钙元素能被海洋生物利用外,还需综合利用的物质是Cl2、BaSO4、BaCO3
(5)“在550℃时,MgCl2?6H2O会分解生成MgO、MgCl2、HCl和水,其中MgO、MgCl2的物质的量之比为3:1”根据反应物、生成物、反应条件及物质的质量关系,书写化学方程式;
(6)已知“该溶液样品25mL与10%的稀硫酸反应,当加入49g稀硫酸时恰好完全中和”,所以参加反应的硫酸质量为:49×10%=4.9克,再根据化学方程式进行计算,求参加反应的氢氧化钠的质量;再求得该溶液样品中氢氧化钠的质量分数.
(2)由MgCl2溶液得到MgCl2?6H2O也需要蒸发,根据溶解度曲线,蒸发的目的是得到热饱和溶液;
(3)①玻璃棒的作用;②钡离子除掉硫酸根;③盐酸除掉过多的碳酸钠;
(4)该流程的副产品中,除钙元素能被海洋生物利用外,还需综合利用的物质是Cl2、BaSO4、BaCO3
(5)“在550℃时,MgCl2?6H2O会分解生成MgO、MgCl2、HCl和水,其中MgO、MgCl2的物质的量之比为3:1”根据反应物、生成物、反应条件及物质的质量关系,书写化学方程式;
(6)已知“该溶液样品25mL与10%的稀硫酸反应,当加入49g稀硫酸时恰好完全中和”,所以参加反应的硫酸质量为:49×10%=4.9克,再根据化学方程式进行计算,求参加反应的氢氧化钠的质量;再求得该溶液样品中氢氧化钠的质量分数.
解答:解:(1)掌握粗盐提纯的操作方法与步骤,了解蒸发是的注意事项;
(2)由MgCl2溶液得到MgCl2?6H2O也需要蒸发,根据溶解度曲线,蒸发的目的是得到热饱和溶液;
(3)掌握玻璃棒的作用,为制得精盐使用的药品及其作用目的;
(4)该流程的副产品中,除钙元素能被海洋生物利用外,还需综合利用的物质是Cl2、BaSO4、BaCO3
(5)根据反应物、生成物、反应条件及物质的质量关系,书写化学方程式:4MgCl2?6H2O
3MgO+MgCl2+6HCl+21H2O
(6)有已知条件,根据化学方程式进行计算,求参加反应的氢氧化钠的质量;再求得该溶液样品中氢氧化钠的质量分数.
故答为:(1)ac;(2)得到热饱和溶液;(3)搅拌,加速溶解;Na2SO4;除却过量的Na2CO3;(4)Cl2、BaSO4、BaCO3
(5)4MgCl2?6H2O
3MgO+MgCl2+6HCl+21H2O、36.7%
(6)①解:设25mL该溶液样品中含氢氧化钠为x.
参加反应的硫酸质量为:49×10%=4.9克
2NaOH+H2SO4=Na2SO4+2H2O
80 98
x 4.9克
=
x=4克
答:25mL该溶液样品中含氢氧化钠4克.
②
×100%≈13.3%
答:该溶液样品中氢氧化钠的质量分数是13.3%
(2)由MgCl2溶液得到MgCl2?6H2O也需要蒸发,根据溶解度曲线,蒸发的目的是得到热饱和溶液;
(3)掌握玻璃棒的作用,为制得精盐使用的药品及其作用目的;
(4)该流程的副产品中,除钙元素能被海洋生物利用外,还需综合利用的物质是Cl2、BaSO4、BaCO3
(5)根据反应物、生成物、反应条件及物质的质量关系,书写化学方程式:4MgCl2?6H2O
| ||
(6)有已知条件,根据化学方程式进行计算,求参加反应的氢氧化钠的质量;再求得该溶液样品中氢氧化钠的质量分数.
故答为:(1)ac;(2)得到热饱和溶液;(3)搅拌,加速溶解;Na2SO4;除却过量的Na2CO3;(4)Cl2、BaSO4、BaCO3
(5)4MgCl2?6H2O
| ||
(6)①解:设25mL该溶液样品中含氢氧化钠为x.
参加反应的硫酸质量为:49×10%=4.9克
2NaOH+H2SO4=Na2SO4+2H2O
80 98
x 4.9克
| 80 |
| x |
| 98 |
| 4.9 |
x=4克
答:25mL该溶液样品中含氢氧化钠4克.
②
| 4 |
| 25×1.2 |
答:该溶液样品中氢氧化钠的质量分数是13.3%
点评:本题主要考查了氯化钠与粗盐提纯的方法步骤,掌握根据化学方程式计算的方法,了解有关溶质质量分数的简单计算.

练习册系列答案
相关题目
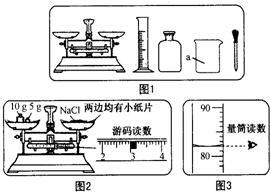 某实验小组利用图1所示仪器进行“配制质量分数一定的氯化钠溶液”的实验:
某实验小组利用图1所示仪器进行“配制质量分数一定的氯化钠溶液”的实验: