题目内容
【题目】如下图所示,实验室用过氧化氢溶液和二氧化锰制取氧气。现将1.1g二氧化锰放入30.2g过氧化氢溶液的锥形瓶中,立即塞紧带导管的橡胶塞,待反应结束后,锥形瓶内剩余物的质量为29.7g。
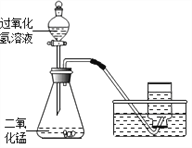
⑴反应中二氧化锰的作用是_______________。
⑵反应结束后,可通过________(填操作名称),得到二氧化锰。
⑶计算参加反应的过氧化氢的质量,写出必要的计算过程____________。(结果精确到0.1 g)。
【答案】 催化作用,加快过氧化氢的分解速率 过滤 3.4g
【解析】(1). 在过氧化氢分解时,二氧化锰的作用为催化作用,加快过氧化氢的分解速率; (2). 二氧化锰不溶于水,可用过滤回收; (3).由质量守恒定律可知反应前后物质的总质量不变,所以氧气的质量为:1.1g+30.2g-29.7g=1.6g。设过氧化氢的质量为x
2H2O2 ![]() 2H2O+O2↑
2H2O+O2↑
68 32
X 1.6g
68/x=32/1.6g X= 3.4g 答略

【题目】小组同学在探究金属与酸反应时,将铝片、锌片打磨后,分别投入盛有等体积、等浓度稀盐酸的试管中,观察到铝与稀盐酸反应较锌与稀盐酸反应快。
【提出问题】金属与盐酸反应快慢,除与金属的种类有关外,还受哪些因素的影响呢?
【猜想与假设】a.可能与盐酸的浓度有关;b. 可能与反应时的温度有关。
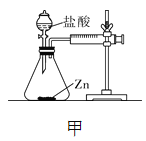
【设计并实验】小明利用如图甲所示装置,用不同质量分数的盐酸和相同形状的锌片进行如下实验。
实验编号 | 盐酸的质量分数(均取20 mL) | 温度/℃ | 记录的数据 |
① | 5% | 30 | |
② | 10% | 20 | |
③ | 5% | 20 | |
④ | 10% | 30 |
【讨论】(1)写出锌与稀盐酸反应的化学方程式__________。
(2)实验时,需将金属片打磨,其目的是__________。
(3)实验前小明先将分液漏斗的活塞关闭,再将注射器活塞往右拉,松手后,观察到注射器活塞回到原处。小明进行该操作的目的是______________。
【分析数据、得出结论】
(4)实验中记录的数据可能是_____________。
(5)对比实验________可知温度对金属与酸反应的速率的影响。
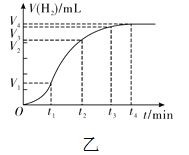
(6)实验表明,四次实验时,反应的速率由快到慢依次为④、②、①、③。根据记录的数据分析,如果盐酸质量分数为10%,温度为25℃,则所记录数据应该介于哪两次实验所记录的数据之间?________________________。
【拓展】进行锌与稀盐酸反应时,试管外壁发烫,并测得实验过程中生成氢气的体积随时间变化的曲线如图乙所示,根据曲线归纳锌与稀盐酸反应速率的变化规律______________,结合上述探究解释曲线变化的原因 ________________________________。
【题目】化学实验是学习化学的基础,请根据下图回答问题:
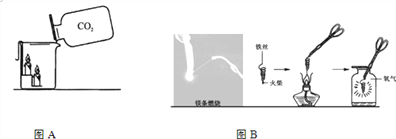
⑴如图A,把二氧化碳气体沿烧杯壁慢慢倒入,观察到的现象是下层蜡烛先熄灭。因此,由这一性质决定的二氧化碳的用途是灭火。
⑵如图B分别取直径相同的镁条和铁丝各15cm,观察它们与氧气反应的现象,记录如下:
物质 | 镁 条 | 铁 丝 |
现象 | 在空气中点燃后,剧烈燃烧,发出耀眼白光。 | 在空气中不燃烧;将铁丝绕成螺旋状并在末端系一根火柴,点燃火柴后,放入氧气中,铁丝剧烈燃烧,火星四射。 |
选择相同长度和直径的上述两种金属做实验的目的是______________,在螺旋状铁丝的末端系一根火柴的作用是____________,写出铁丝在氧气中发生反应的化学方程式_______________________________,此反应属于________________________(填基本反应类型)。瓶中要预先加少量水或铺一层细沙的目的是________________;铁丝在氧气中燃烧的现象为___________________________。