题目内容
【题目】根据下列装置,结合所学化学知识回答下列问题:
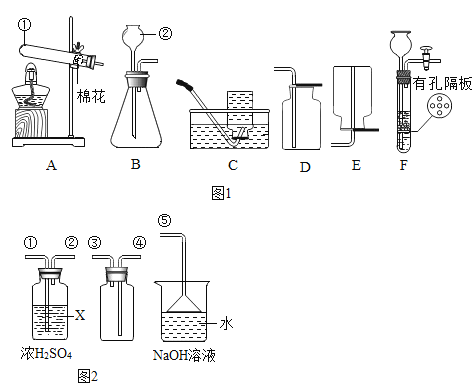
(1)写出有标号的仪器名称:①_____,②_____。
(2)实验室用高锰酸钾制取并收集较纯净O2可选用的收集装置是_____(填字母代号)。
(3)实验室用B、D装置制取CO2的化学方程式为_____,若将发生装置由B改为F,其优点是_____。
(4)SO2是无色有刺激性气味的有毒气体,密度比空气大,易溶于水.SO2的某些化学性质与CO2相似,实验中常用NaOH溶液吸收SO2尾气.用如图2所示装置收集一瓶干燥的SO2,装置中导管按气流方向连接顺序是①→②→④→③→⑤;图中漏斗的作用是_____;烧杯中NaOH溶液的作用_____。
【答案】试管 长颈漏斗 C ![]() 可以控制反应的发生和停止 防止倒吸 吸收二氧化硫,防止污染空气
可以控制反应的发生和停止 防止倒吸 吸收二氧化硫,防止污染空气
【解析】
(1)仪器①的名称为:试管;仪器②的名称为:长颈漏斗;
(2)氧气不易溶于水,密度比空气大,可用向上排空气法或排水法收集,排水法收集的氧气比较纯净,故可选用的收集装置是:C;
(3)B装置适用于固、液不加热反应制取气体,实验室常用石灰石(或大理石)与稀盐酸反应制取二氧化碳,石灰石的主要成分是碳酸钙,碳酸钙与稀盐酸反应生成氯化钙、二氧化碳和水,该反应的化学方程式为:![]() ;
;
若将发生装置由B改为F,其优点是:可以控制反应的发生和停止,将石灰石置于有孔隔板上,关闭止水夹,通过长颈漏斗添加稀盐酸,使固液接触,反应发生,产生气体,装置内压强增大,将稀盐酸压入长颈漏斗中,固液分离,反应停止,打开止水夹,固液接触,反应发生,故填:可以控制反应的发生和停止;
(4)SO2是无色有刺激性气味的有毒气体,排放到空气中会污染空气,氢氧化钠能与二氧化硫反应生成亚硫酸钠和水,故可用氢氧化钠来吸收二氧化硫,防止污染空气,氢氧化钠与二氧化硫反应,消耗气体,会使装置内压强减小,在外界大气压的作用下,使液体倒吸,漏斗可以防止倒吸,故填:防止倒吸、吸收二氧化硫,防止污染空气。

【题目】下图是初中化学常用的实验装置,请根据实验要求选择适当的装置并完成相关问题。

①写出编号仪器的名称:a___________;b__________。
②实验室欲制取并收集干燥的二氧化碳气体,应选用的装置依次为______________(填仪器编号),反应方程式是_____________。将生成的气体通入装置 D,若无明显现象,可能的原因是(装置气密性良好)______________。
③某小组欲探究二氧化锰的用量对氯酸钾分解速率的影响设计了如下实验:用 9 g 的氯酸钾分别与不同质量的二氧化锰混合加热(反应过程中其他条件均相同)记录从开始加 热到收集满一集气瓶氧气(约 250 mL)所需的时间,如下表:
氯酸钾质量(g) | 9 | 9 | 9 |
二氧化锰质量(g) | 1 | 2 | 3 |
完成实验的时间(s) | 60 | 55 | 23 |
该实验应选用的发生装置是____________,反应方程式是____________ 。甲同学认为用装置 G 收集,乙同学认为应该用装置 H 收集,你认为应采用装置_________(填仪器编号)收集更适合该项实验,理由是_________。
【题目】如图是a、b、c三种物质的溶解度曲线。根据图回答:
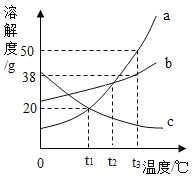
(1)_____℃时,a和c的溶解度相等。
(2)t3℃时,把20ga、b、c三种物质分别加入盛有50g水的烧杯中不断搅拌,所得溶液的溶质质量分数大小关系为_____(填选项字母,下同);若将温度降低到t1℃时,溶液质量的大小关系为_____。
A c>a=bB b>a=cC a>b>cD b>a>c
(3)在t2℃时,将c物质的不饱和溶液变为饱和溶液,下列有关说法不正确的是_____(填字母)。
A 溶剂的质量可能变小B 溶液的质量可能变大
C 溶质的质量分数一定变大D 溶质的质量一定不变
(4)将纯净的氯化钠配制成溶液。20℃时,向4个盛有200g水的烧杯中,分别加入一定质量的氯化钠并充分溶解。4组实验数据如下:
实验序号 | ① | ② | ③ | ④ |
加入氯化钠的质量/g | 9 | 36 | 81 | 90 |
溶液质量/g | 209 | 236 | 272 | 272 |
若将①中得到的溶液稀释成质量分数为0.9%的生理盐水,需加水的质量是_____g。
关于上述实验的叙述正确的是_____(填序号)。
a、①②所得溶液是不饱和溶液
b、③④所得溶液中,溶质的质量分数不相等
c、20℃时,200g水中最多溶解氯化钠的质量为72g
d、20℃时,将④继续恒温蒸发100g水,过滤,得到质量为36g的固体
(5)现有两种金属单质组成的混合物。向100g某稀盐酸中加入该混合物(假设能与酸反应的的金属都能全部反应),混合物的质量与生成氢气的质量关系如图所示。
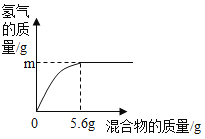
下列说法正确的是_____(填序号)。
a、若混合物为Zn、Al,则m可能是0.2g
b、若混合物为Zn、Cu,则m一定大于0.2g
c、若混合物为Fe、Al,则稀盐酸中溶质质量分数不一定大于7.3%
d、若混合物为Fe、Cu,m为0.1g,则该混合物中Fe的质量分数一定是50%