题目内容
为了测定某石灰石样品中碳酸钙的含量,取20g此样品,将80g的稀盐酸分四次加入样品使之充分反应(石灰石中的杂质不溶于水,也不与盐酸及生成物反应),每次用盐酸的质量与反应后剩余固体的质量见下表.(计算结果保留到小数点后一位数字)| 次 数 | 一 | 二 | 三 | 四 |
| 加入盐酸的质量/g | 20 | 20 | 20 | 20 |
| 剩余固体的质量/g | 15 | 10 | 5 | 5 |
(2)20g此样品与足量盐酸反应最多生成二氧化碳的质量;
(3)加入的稀盐酸中溶质的质量分数.
【答案】分析:(1)比较第一、二、三次的数据可知:20g盐酸完全反应可以消耗碳酸钙15g-10g=5g;第四次中固体不再减少,说明此时碳酸钙已完全反应,样品中含有5g杂质,所以碳酸钙质量为15g,然后计算质量分数;
(2)根据碳酸钙的质量依据方程式计算二氧化碳的质量;
(3)根据反应的化学方程式,由参加反应的碳酸钙的质量计算盐酸完全反应时消耗的HCl的质量,利用HCl的质量稀盐酸的质量×100%计算该稀盐酸的质量分数;
解答:解:(1)比较第一、二、三次的数据可知:20g盐酸完全反应可以消耗碳酸钙15g-10g=5g;第四次中固体不再减少,说明此时碳酸钙已完全反应,样品中含有5g杂质,所以碳酸钙质量为15g,所以碳酸钙质量分数为: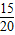 ×100%=75%;
×100%=75%;
(2)设15g的碳酸钙生成二氧化碳为x,
CaCO3+2HCl=CaCl2+H2O+CO2↑
100 73 44
15 X
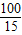 =
=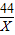
X=6.6g
设与10克碳酸钙反应的HCl的质量为y
CaCO3+2HCl=CaCl2+H2O+CO2↑
100 73
10 y
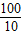 =
=
y=7.3g
所以盐酸的质量分数为: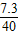 ×100%=18.25%.
×100%=18.25%.
答:样品中碳酸钙的质量分数为75%,最多生成二氧化碳的质量6.6g,加入的稀盐酸中溶质的质量分数为18.25%.
点评:根据反应进行参加反应的溶液溶质质量分数计算时,一定要选取溶液中溶质完全反应时的数据计算溶液中溶质的质量,这样求得的溶质质量才是溶液中全部溶质的质量.
(2)根据碳酸钙的质量依据方程式计算二氧化碳的质量;
(3)根据反应的化学方程式,由参加反应的碳酸钙的质量计算盐酸完全反应时消耗的HCl的质量,利用HCl的质量稀盐酸的质量×100%计算该稀盐酸的质量分数;
解答:解:(1)比较第一、二、三次的数据可知:20g盐酸完全反应可以消耗碳酸钙15g-10g=5g;第四次中固体不再减少,说明此时碳酸钙已完全反应,样品中含有5g杂质,所以碳酸钙质量为15g,所以碳酸钙质量分数为:
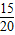 ×100%=75%;
×100%=75%;(2)设15g的碳酸钙生成二氧化碳为x,
CaCO3+2HCl=CaCl2+H2O+CO2↑
100 73 44
15 X
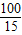 =
=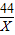
X=6.6g
设与10克碳酸钙反应的HCl的质量为y
CaCO3+2HCl=CaCl2+H2O+CO2↑
100 73
10 y
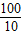 =
=
y=7.3g
所以盐酸的质量分数为:
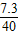 ×100%=18.25%.
×100%=18.25%.答:样品中碳酸钙的质量分数为75%,最多生成二氧化碳的质量6.6g,加入的稀盐酸中溶质的质量分数为18.25%.
点评:根据反应进行参加反应的溶液溶质质量分数计算时,一定要选取溶液中溶质完全反应时的数据计算溶液中溶质的质量,这样求得的溶质质量才是溶液中全部溶质的质量.

练习册系列答案
相关题目
石灰石是我市的一种重要矿产资源,为了测定某石灰石样品中碳酸钙的含量,某同学用该石灰石样品与稀盐酸反应(杂质既不溶于水也不与盐酸反应),进行了三次实验,所得相关的实验数据记录如下(实验中的误差忽略不计):
(1)请计算该石灰石样品中碳酸钙的质量分数.
(2)从上表数据中分析,当所取石灰石与所用稀盐酸的质量比为 时,表明石灰石中的碳酸钙与稀盐酸中的氯化氢恰好完全反应.
| 第一次 | 第二次 | 第三次 | |
| 所取石灰石合金的质量/g | 25 | 25 | 50 |
| 所用稀盐酸的质量/g | 120 | 160 | 100 |
| 二氧化碳的质量/g | 9.9 | 9.9 | 9.9 |
(2)从上表数据中分析,当所取石灰石与所用稀盐酸的质量比为