题目内容
【题目】酸雨是天空降水呈酸性(pH小于5.6)的统称,个别地方酸雨的pH竟低于2.1(食醋的pH=3),可见其严重程度.形成酸雨的主要物质是大气中的SO2和氮氧化物.
(1)SO2主要来源是煤和石油的燃烧,全世界每年有1.5亿吨SO2的排放量.SO2在空气中受阳光及尘埃等催化时可被氧化,最终与雨水形成酸雨.试写出这一过程中所发生的两个化学反应方程式:_____;_____.
(2)酸雨可导致的危害有_____(填编号).
A 腐蚀建筑物
B 导致树木枯萎
C 造成洪涝灾害
D 影响农作物生长
(3)为了减少酸雨的形成,必须减少SO2的排放量,熟石灰的悬浊液、澄清石灰水、浓NaOH溶液都能吸收废气中的SO2,从净化效果、净化成本等方面综合考虑,你认为用哪一种试剂比较合理?请用简要的文字说明理由:_____.
【答案】2SO2+O2 2SO3 SO3+H2O═H2SO4 ABD 熟石灰悬浊液,澄清石灰水中Ca(OH)2的浓度小,吸收SO2的量少且速度慢,效果不佳;浓NaOH溶液清除SO2效果虽好,但其价格高,会导致生产成本的上升,熟石灰悬浊液克服了上述两者的缺点,是一种价廉物美的SO2吸收剂.故选用熟石灰悬浊液比较适宜
2SO3 SO3+H2O═H2SO4 ABD 熟石灰悬浊液,澄清石灰水中Ca(OH)2的浓度小,吸收SO2的量少且速度慢,效果不佳;浓NaOH溶液清除SO2效果虽好,但其价格高,会导致生产成本的上升,熟石灰悬浊液克服了上述两者的缺点,是一种价廉物美的SO2吸收剂.故选用熟石灰悬浊液比较适宜
【解析】
(1)二氧化硫能与氧气反应生成三氧化硫,三氧化硫能与水反应生成硫酸,故答案为:2SO2+O2![]() 2SO3,SO3+H2O═H2SO4;
2SO3,SO3+H2O═H2SO4;
(2)酸雨的主要成分是硫酸或硝酸,能腐蚀建筑物,导致树木枯萎,影响农作物生长,不会造成洪涝灾害,所以本题答案为:ABD;
(3)氢氧化钙是微溶于水的物质,溶液中所含的氢氧化钙的量少,氢氧化钠吸收二氧化硫的程度比氢氧化钙强,但是氢氧化钠的价格高,故答案为:熟石灰悬浊液,澄清石灰水中Ca(OH)2的浓度小,吸收SO2的量少且速度慢,效果不佳;浓NaOH溶液清除SO2效果虽好,但其价格高,会导致生产成本的上升,熟石灰悬浊液克服了上述两者的缺点,是一种价廉物美的SO2吸收剂.故选用熟石灰悬浊液比较适宜.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】如表为两种物质在不同温度时的溶解度,请回答
温度/℃ | 0 | 20 | 40 | 60 | 80 | 100 | |
溶解度/g | KCl | 27.6 | 34.0 | 40.0 | 45.5 | 51.1 | 56.7 |
KNO3 | 13.3 | 31.6 | 63.9 | 110 | 169 | 246 | |
(1)60℃时,100g 水中最多可溶解_______gKCl 即可达到饱和
(2)40℃时,将 30gKCl加入到 50g 水中,充分溶解后所得溶液是_______ 溶液(填写“饱和”或“不饱和”);
(3)从表中信息可知,在______温度范围内 KNO3 和 KCl 的溶解度相等
(4)将 20℃时 KNO3 和 KCl 的两种饱和溶液升温至 60℃,则两种溶液的溶质质量分数大小关系是:KNO3_________________________KCl(填写“>”、“<”或“=”).
【题目】某厂废水中含有质量分数为4.9%的H2SO4,需中和后才能排放.某兴趣小组同学经过讨论,提出了两种中和方案,所用试剂的价格如下:
中和试剂 | 氢氧化钠 | 氢氧化钙 |
价格/(元吨﹣1) | 800 | 450 |
(1)请从经济与产物角度说明选择氢氧化钙的理由:
①_____;②_____.
(2)有同学建议用氨水进行中和,可以回收一种化肥,其化学式为_____.该废水还会引起的环境问题是_____(选填编号).
A 重金属污染 B 有毒物质污染 C 富营养化污染 D 悬浮物污染
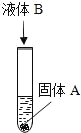
【题目】如图所示,试管中盛有固体物质 A,向试管中加入一种液体物质 B 后,观察 到有气泡产生.请你依据上述实验现象,对 A和 B 的组合至少做出三种猜想(要求三种组合中 的固体 A 分别属于不同类别的物质):
A | B | |
猜想 1 | ____ | ____ |
猜想 2 | ____ | ____ |
猜想 3 | ____ | ____ |