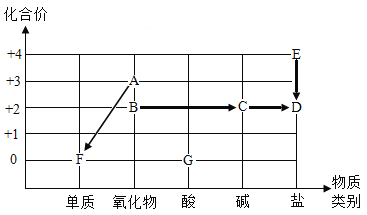
题目内容
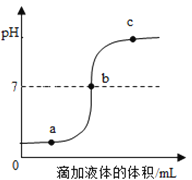
【题目】向稀盐酸中滴加一定量的Ca(OH)2溶液如图甲;取甲反应后的溶液,滴加Na2CO3溶液,溶液pH的变化如图乙.
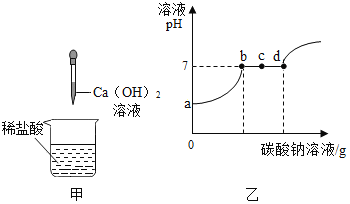
已知:CaCl2、NaCl的水溶液均呈中性.回答问题:
(1)由图乙可以推知:甲反应后的溶液中溶质是 ______ (填化学式).
(2)c点对应的溶液中的溶质是 ______ (填化学式).
(3)欲将甲反应后的溶液调节至中性,在没有指示剂的情况下,应加入的物质是 ______ (填序号).
A CaO B Ca(OH)2 C CaCO3
【答案】CaCl2和HCl NaCl和CaCl2 C
【解析】
(1)氢氧化钙与盐酸反应生成氯化钙和水,根据题目的信息可知,pH变化情况溶液最初pH<7,所以甲反应后的溶液中一定含CaCl2和HCl
(2)在含有CaCl2和HCl溶液中加入碳酸钠,碳酸钠先与盐酸反应生成氯化钠、水和二氧化碳,当盐酸完全反应后,碳酸钠与氯化钙反应生成碳酸钙和氯化钠。根据溶液pH的变化图乙可知ab段是碳酸钠与盐酸反应,bd段是碳酸钠与氯化钙反应,d点之后碳酸钠过量;所以c点是氯化钙过量的,所以此时溶质为氯化钠和氯化钙,化学式分别为:NaCl和CaCl2;
(3)A CaO能与盐酸反应生成氯化钙和水,过量的氧化钙能与水反应生成氢氧化钙,若不用指示剂,不好判断反应是否恰好进行,容易引入新的杂质氢氧化钙,故A错误;
B Ca(OH)2能与盐酸反应生成氯化钙和水,若不用指示剂,不好判断反应是否恰好进行,容易引入新的杂质氢氧化钙,故B错误;
C 盐酸能与过量的CaCO3粉末反应生成氯化钙、水和二氧化碳,再过滤除去过量的难溶于水的碳酸钙粉末,能除去杂质且没有引入新的杂质,符合除杂原则,故C正确。故选C。

【题目】化学链燃烧是新的燃烧概念,即燃料不直接与空气接触燃烧,而是以载氧体(如CaSO4等)在两个反应器之间的循环来实现燃料的燃烧过程(如图1)。请回答下列问题:
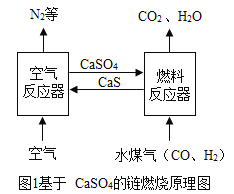
(1)空气反应器中主要发生化合反应,化学方程式为_____。燃料反应器中, CO与CaSO4发生的反应方程式为 。
。
(2)实验室模拟CO与石膏(CaSO4﹒2H2O)的反应,并测定CO与石膏(CaSO4﹒2 H2O)是否反应完全,设计装置如图2。
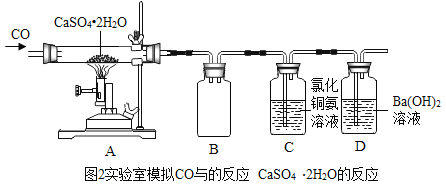
①广口瓶B的作用是_____。C中反应的化学方程式为![]() _____
_____![]() ,C装置的作用是_____,该实验的尾气无毒。
,C装置的作用是_____,该实验的尾气无毒。
②完成实验报告(已知:热的CaS会跟氧气反应;氯化亚铜和氨水混合溶液为无色)。
实验步骤 | 现象 | 分析与解释 |
检查气密性并装填好药品后,首先应先通一会CO | C中_____(填反应现象) | |
点燃A处酒精喷灯 | D中_____(填反应现象) | |
停止加热,继续通一会CO,直到装置冷却 | 继续通CO目的:(1)使生成的CO2全部被氢氧化钡溶液吸收; (2)_____ | |
取A中残留固体,加足量稀盐酸 | _____(填反应现象),有少量不溶物 |
|
(3)若所取石膏样品(CaSO4﹒2 H2O)质量为1.00g,装置D中产生的BaCO3的质量为3.94g,求石膏样品的转化率。_____(转化率:![]() ,己知BaCO3的相对分子质量为197)(写出计算过程)
,己知BaCO3的相对分子质量为197)(写出计算过程)
(4)D装置中不宜使用澄清石灰水的理由是_____。