题目内容
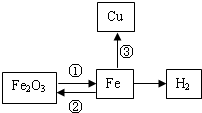 构建知识网络是一种重要的学习方法.图为某校化学学习小组的小阳同学绘制的铁的化学性质网络示意图.请分析回答下列问题:
构建知识网络是一种重要的学习方法.图为某校化学学习小组的小阳同学绘制的铁的化学性质网络示意图.请分析回答下列问题:(1)反应①中可用
(2)写出高炉中发生的反应①的化学方程式:
(3)反应②导致每年有大量的钢铁锈蚀,为阻止该反应的发生,人们常采用在钢铁表面涂刷油漆或镀上其它金属等方法.这两种方法的共同原理是阻止钢铁与
(4)该化学学习小组为了分析生铁中铁的含量,进行了如下实验研究:取12g生铁与10%的盐酸反应,并绘制了加入盐酸质量与放出气体质量的关系图(见下图).(说明:生铁中杂质不溶于水,不与盐酸、硫酸铜溶液反应.)
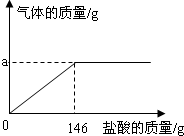
①铁完全反应用去盐酸的质量为
②生铁中铁的质量分数为多少?(写出计算过程,结果保留到小数点后一位)
(5)某同学列出了如下计算式:生铁与盐酸刚好反应完全时所得溶液质量=(146+12-a)g,小明对该计算式提出了质疑,请指出其中的错误
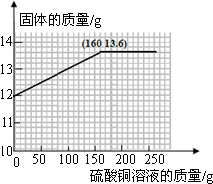
(6)小华另设计了一个实验方案:用12g生铁粉与20%的硫酸铜溶液反应来分析生铁中铁的含量.请你画出加入硫酸铜溶液质量与固体质量变化关系的曲线.
分析:(1)常用的还原剂有碳、一氧化碳和氢气三种;
(2)高炉炼铁是用一氧化碳还原氧化铁;铁置换铜是铁和铜的盐溶液反应;
(3)铁生锈的条件是铁与氧气和水同时接触;
(4)有图可直接看出完全反应消耗盐酸溶液的质量,根据铁和盐酸反应的方程式,利用盐酸溶质质量可得到参加反应的铁的质量,进而求出生铁中铁的质量分数;
(5)反应后溶液质量=参加反应的固体质量+液体质量-沉淀质量-气体质量;
(6)此图的起点容易找到,关键是找到拐点,即铁和硫酸铜恰好完全反应时消耗的硫酸铜溶液的质量,和剩余固体的质量.
(2)高炉炼铁是用一氧化碳还原氧化铁;铁置换铜是铁和铜的盐溶液反应;
(3)铁生锈的条件是铁与氧气和水同时接触;
(4)有图可直接看出完全反应消耗盐酸溶液的质量,根据铁和盐酸反应的方程式,利用盐酸溶质质量可得到参加反应的铁的质量,进而求出生铁中铁的质量分数;
(5)反应后溶液质量=参加反应的固体质量+液体质量-沉淀质量-气体质量;
(6)此图的起点容易找到,关键是找到拐点,即铁和硫酸铜恰好完全反应时消耗的硫酸铜溶液的质量,和剩余固体的质量.
解答:解:(1)可以做还原剂有C或H2或CO,所以在①处可任写一个.
(2)高炉炼铁是一个复杂的过程,其中主要是利用焦炭和氧气反应生成的一氧化碳把铁从铁矿石中还原出来,方程式为Fe2O3+3CO
2Fe+3CO2
铁和铜的盐溶液反应可把铜置换出来,如方程式有Fe+CuSO4═FeSO4+Cu或Fe+CuCl2═FeCl2+Cu或 Fe+Cu(NO3)2═Fe(NO3)2+Cu.
(3)铁生锈的条件是铁与氧气和水同时接触,所以防止铁生锈的原理就是使铁隔绝空气和水(或氧气和水).
(4)①有图可知铁完全反应时消耗的盐酸质量是146g.
②解:设与盐酸反应的铁的质量为x.
Fe+2HCl=FeCl2+H2↑
56 73
x 146 g×10%=14.6 g
=
解得:x=11.2g
生铁中铁的质量分数为:
×100%=93.3%
答:生铁中铁的质量分数为93.3%.
(5)因为溶液质量不包括氢气质量和剩余杂质的质量,所以还要减去杂质的质量.
(6)铁和硫酸铜还未反应时固体就是铁质量为12g,故起点应从纵轴上12开始画起;
然后找拐点,即铁和硫酸铜恰好完全反应时消耗的硫酸铜溶液质量及固体质量,
设铁和硫酸铜恰好完全反应时消耗硫酸铜溶液为y,生成铜为z
Fe+CuSO4 ═FeSO4 +Cu
56 160 64
11.2g 20%?y z
=
y=160g
=
z=12.8g
12g生铁中所含杂质为:12g-11.2g=0.8g
所以铁和硫酸铜恰好完全反应时固体质量为:12.8g+0.8g=13.6g
即拐点处横坐标值为160,纵坐标值为13.6,然后把拐点和起点连起来,并且在拐点后画一条平行于x轴的直线,就得到了所要的曲线图.
故答案为:(1)CO;(2)Fe2O3+3CO
2Fe+3CO2,Fe+CuSO4═FeSO4+Cu;
(3)空气和水;
(4)①146,②93.3%;
(5)溶液质量不包括剩余杂质的质量,所以还要减去杂质的质量;
(6)
(2)高炉炼铁是一个复杂的过程,其中主要是利用焦炭和氧气反应生成的一氧化碳把铁从铁矿石中还原出来,方程式为Fe2O3+3CO
| ||
铁和铜的盐溶液反应可把铜置换出来,如方程式有Fe+CuSO4═FeSO4+Cu或Fe+CuCl2═FeCl2+Cu或 Fe+Cu(NO3)2═Fe(NO3)2+Cu.
(3)铁生锈的条件是铁与氧气和水同时接触,所以防止铁生锈的原理就是使铁隔绝空气和水(或氧气和水).
(4)①有图可知铁完全反应时消耗的盐酸质量是146g.
②解:设与盐酸反应的铁的质量为x.
Fe+2HCl=FeCl2+H2↑
56 73
x 146 g×10%=14.6 g
| 56 |
| x |
| 73 |
| 14.6g |
解得:x=11.2g
生铁中铁的质量分数为:
| 11.2g |
| 12g |
答:生铁中铁的质量分数为93.3%.
(5)因为溶液质量不包括氢气质量和剩余杂质的质量,所以还要减去杂质的质量.
(6)铁和硫酸铜还未反应时固体就是铁质量为12g,故起点应从纵轴上12开始画起;
然后找拐点,即铁和硫酸铜恰好完全反应时消耗的硫酸铜溶液质量及固体质量,
设铁和硫酸铜恰好完全反应时消耗硫酸铜溶液为y,生成铜为z
Fe+CuSO4 ═FeSO4 +Cu
56 160 64
11.2g 20%?y z
| 56 |
| 160 |
| 11.2g |
| 20%?y |
| 160 |
| 64 |
| 20%?y |
| z |
12g生铁中所含杂质为:12g-11.2g=0.8g
所以铁和硫酸铜恰好完全反应时固体质量为:12.8g+0.8g=13.6g
即拐点处横坐标值为160,纵坐标值为13.6,然后把拐点和起点连起来,并且在拐点后画一条平行于x轴的直线,就得到了所要的曲线图.
故答案为:(1)CO;(2)Fe2O3+3CO
| ||
(3)空气和水;
(4)①146,②93.3%;
(5)溶液质量不包括剩余杂质的质量,所以还要减去杂质的质量;
(6)

点评:此题是综合性较强的题目,包括的问题较多,涉及的知识面很广,属于难度较大的题目.

练习册系列答案
相关题目
 33、构建知识网络是一种重要的学习方法.如图是关于盐酸化学性质的知识网络,“--”表示相连的两种物质能发生反应,“→”表示一种物质转化成另一种物质.A、C属于不同类别的化合物.完善这个知识网络.
33、构建知识网络是一种重要的学习方法.如图是关于盐酸化学性质的知识网络,“--”表示相连的两种物质能发生反应,“→”表示一种物质转化成另一种物质.A、C属于不同类别的化合物.完善这个知识网络. 构建知识网络是一种重要的学习方法.小李同学对物质的组成和结构方面的知识进行了归纳,请你填写空白,完成他的设计.
构建知识网络是一种重要的学习方法.小李同学对物质的组成和结构方面的知识进行了归纳,请你填写空白,完成他的设计. 18、构建知识网络是一种重要的学习方法.小李同学对物质组成和结构方面的知识进行了归纳,请你填写空白,完成他的设计.
18、构建知识网络是一种重要的学习方法.小李同学对物质组成和结构方面的知识进行了归纳,请你填写空白,完成他的设计. (2013?乌鲁木齐)构建知识网络是一种重要的学习方法.如图是关于硫酸化学性质的知识网络:“-”表示相连的两种物质能发生反应,“→”表示一种物质能转化为另一种物质,A,B,C分别属于不同类别的化合物,则A,B,C可能是( )
(2013?乌鲁木齐)构建知识网络是一种重要的学习方法.如图是关于硫酸化学性质的知识网络:“-”表示相连的两种物质能发生反应,“→”表示一种物质能转化为另一种物质,A,B,C分别属于不同类别的化合物,则A,B,C可能是( )