题目内容
【题目】小聪同学家新换了水龙头,从说明书上了解到该水龙头是铜质镀铬。好奇的小聪想探究铬(Cr)与常见金属铁、铜的活动性强弱,邀请你一同参加。
【知识回放】金属活动性顺序:(请你在横线上填写所缺的金属的元素符号)
K Ca NaMg Al__FeSnPb(H) Cu Hg __Pt Au
【作出猜想】
猜想1:Fe>Cu>Cr
猜想2:Fe>Cr>Cu
(你的猜想)猜想3:________________。
【查阅资料】
(1)铬是银白色有光泽的金属,在空气中其表面能生成抗腐蚀的致密的氧化膜。
(2)铬能与稀硫酸反应,生成蓝色的硫酸亚铬(CrSO4)溶液。
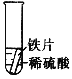
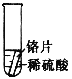
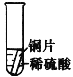
【设计与实验】小聪同学取大小相等的三种金属片,用砂纸打磨光亮;再取三支试管,在常温下分别放入等量的同种浓度的稀硫酸中。请填写试管3中的实验现象
实验 | 试管1 | 试管2 | 试管3 |
实验操作 |
|
|
|
实验现象 | 铁片表面产生气泡较慢,溶液变为浅绿色 | 铬片表面产生气泡较快,溶液变为蓝色 | ________ |
【结论与解释】
(1)小聪得到的结论是猜想_________正确。
(2)实验前用砂纸打磨金属片的目的是___________________________________________。
【知识运用】将铬片投入FeSO4溶液中,反应________(填“能”或“不能”)进行。若能进行,请你写出反应的化学方程式:___________
【答案】 Zn Ag Cr>Fe>Cu 没有明显变化(或没有气泡产生) 猜想3 除去金属表面的氧化膜,便于金属和稀硫酸顺利反应 能 Cr + FeSO4 == CrSO4 + Fe
【解析】(1)常见金属活动性顺序为K、Ca、Na、Mg、Al、Zn、Fe、Sn、Pb、(H)、Cu、Hg、Ag、Pt、Au,故所缺金属为Zn和Ag;(2)三种金属的活动性顺序可能存在三种情况:猜想1为Fe>Cu>Cr;猜想2为Fe>Cr>Cu,故猜想3 Cr>Fe>Cu;(3)因为铜的活动性顺序位于氢的后面,因此不能和酸反应,表现为无现象;(4)试管1中实验现象铁片表面产生气泡较慢,溶液变为浅绿色,可知金属铁在金属活动顺序中排在氢前,根据铬片表面产生气泡较快,溶液变为蓝色,从而得出铬也排在氢前且铬比铁活泼,因为铜不能和稀硫酸反应生成氢气,可知铜排在氢的后面,故猜想3、Cr>Fe>Cu正确;(2)实验前用砂纸打磨金属片的目的是:除去金属表面的氧化膜,便于金属和稀硫酸顺利反应;(5)因为“铬片表面产生气泡较快溶液变为蓝色”,可知金属铬比铁活泼强,,故铬能和硫酸亚铁反应生成硫酸铬和铁,则反应的化学方程式为:Cr+FeSO4=Fe+CrSO4。

 孟建平错题本系列答案
孟建平错题本系列答案 超能学典应用题题卡系列答案
超能学典应用题题卡系列答案