题目内容
【题目】同学们学习”二氧化碳实验室制取的研究”课题时,探究了二氧化碳的收集方法。
(查阅资料)
(1)通常状况下 1 体积水约溶解 1 体积二氧化碳,所得溶液的 pH 约为 5.6,pH 越小,二氧 化碳在水中溶解越多。
(2)石灰石中的杂质既不和盐酸反应,也不溶于水。
(提出问题)二氧化碳能不能用排水法收集?
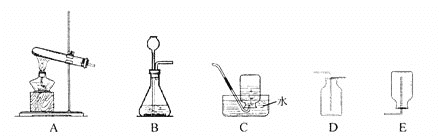
(设计实验) 实验一:在通常状况下,测定二氧化碳溶于水所得溶液的 pH,判断二氧化碳 在水中溶解的体积,如下图:
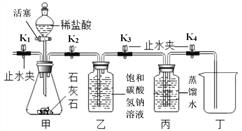
(1)甲装置中反应的化学方程式_____;
(2)检查甲装置气密性的方法是关闭活塞和止水夹 K1 ,打开 K2,K3,K4 双手握住锥形瓶, 观察到_____,说明装置气密性良好;
(3)实验时,需先将甲装置中的空气排尽。其操作是打开止水夹 K1,关闭止水夹 K2 ,打开 活塞,滴加稀盐酸至空气排尽。检验空气排尽的方法是 _____;
(4)关闭 K1 ,打开 K2 、K3 、K4 ,待丙装置中收集半瓶气体时,关闭 K2 、K3 、K4 ,充 分振荡丙装置,分别测得丙、丁瓶装置中溶液的 pH 为 5.5 和 6.5。分析可知,溶解的二氧化碳体积丙装置中_____(填“大于”或“等于”或“小于”)丁装置,乙装置的作用是 _____ ;
(5)实验结束后,装置甲反应后溶液中溶质除了氯化钙还有没有其他物质?请设计实验证明你的猜想(写出实验方法、现象和结论)______
(6)实验二:用二氧化碳数字传感器测得收集的气体中二氧化碳体积分数。如图是收集的 气体中二氧化碳体积分数随时间变化的关系图,从图中能得息:
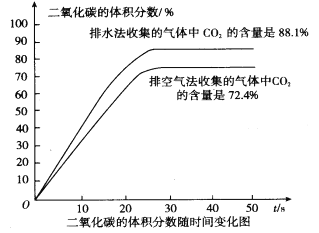
① ________________________________________
②___________________________________________________
(结论反思)由实验一、二分析,改进实验装置,二氧化碳能用排水法收集。能降低二氧 化碳在水中溶解性的措施③_____④_____。
【答案】 CaCO3+2HCl=CaCl2+CO2↑+H2O 乙中有气泡冒出 将燃着的小木条放在K1侧管口,木条熄灭,则空气已排尽 大于 除去二氧化碳中可能混有的氯化氢 取少量反应后的溶液于试管中,加入几滴紫色石蕊溶液,溶液变红则甲中溶质为氯化 钙和氯化氢 排水法收集的二氧化碳比排空气法收集的二氧化碳浓度大 排水法和排空气法均不能收集到纯净的二氧化碳 将水换成热水 将水换成饱和的碳酸氢钠溶液
【解析】(1)甲装置中是稀盐酸与碳酸钙反应生成氯化钙、二氧化碳和水;
(2)检查该装置的气密性的方法是双手握住锥形瓶,如乙装置中有气泡冒出,则气密性良好;
(3)检验空气排尽的方法是将燃着的小木条放在K1侧管口,木条熄灭,则空气已排尽;
(4)由于丙装置中的pH小于丁装置中的pH,故丙装置中溶解二氧化碳的体积大于丁装置中溶解的二氧化碳的体积;甲装置中制取的二氧化碳气体中可能混有氯化氢气体,故用饱和碳酸氢钠除去氯化氢气体;
(5)甲装置中含有的溶质一定有生成的氯化钙,可能含有过量的稀盐酸,故取少量反应后的溶液于试管中,加入几滴紫色石蕊溶液,溶液变红则甲中溶质为氯化 钙和氯化氢;
(6)由图可知,排水法收集的二氧化碳比排空气法收集的二氧化碳浓度大;排水法和排空气法均不能收集到纯净的二氧化碳
(7)二氧化碳气体的溶解度随温度的升高而降低,故可以用热水代替冷水,也可以用饱和碳酸氢钠溶液代替水;

【题目】小聪同学家新换了水龙头,从说明书上了解到该水龙头是铜质镀铬。好奇的小聪想探究铬(Cr)与常见金属铁、铜的活动性强弱,邀请你一同参加。
【知识回放】金属活动性顺序:(请你在横线上填写所缺的金属的元素符号)
K Ca NaMg Al__FeSnPb(H) Cu Hg __Pt Au
【作出猜想】
猜想1:Fe>Cu>Cr
猜想2:Fe>Cr>Cu
(你的猜想)猜想3:________________。
【查阅资料】
(1)铬是银白色有光泽的金属,在空气中其表面能生成抗腐蚀的致密的氧化膜。
(2)铬能与稀硫酸反应,生成蓝色的硫酸亚铬(CrSO4)溶液。
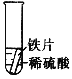
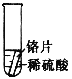
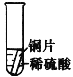
【设计与实验】小聪同学取大小相等的三种金属片,用砂纸打磨光亮;再取三支试管,在常温下分别放入等量的同种浓度的稀硫酸中。请填写试管3中的实验现象
实验 | 试管1 | 试管2 | 试管3 |
实验操作 |
|
|
|
实验现象 | 铁片表面产生气泡较慢,溶液变为浅绿色 | 铬片表面产生气泡较快,溶液变为蓝色 | ________ |
【结论与解释】
(1)小聪得到的结论是猜想_________正确。
(2)实验前用砂纸打磨金属片的目的是___________________________________________。
【知识运用】将铬片投入FeSO4溶液中,反应________(填“能”或“不能”)进行。若能进行,请你写出反应的化学方程式:___________
【题目】下面是兴趣小组同学对暴露在空气的氢氧化钠固体的探究.请回答下列问题:
[提出问题1]: 该氢氧化钠固体有没有变质呢?
[进行实验1]:甲同学取少量固体于试管中用足量的水溶解,后加入过量的 BaCl2 溶液,观察到_________________,证明氢氧化钠固体已经含有 Na2CO3.
[提出问题2]:
如何除去氢氧化钠固体中的杂质,得到纯净的氢氧化钠呢?
[进行实验2]:乙同学对该氢氧化钠固体进行提纯,按如下操作流程进行实验.
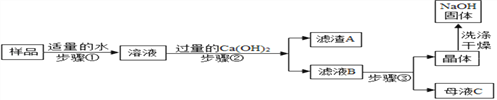
[实验分析]:
⑴步骤②反应的化学方程式是____________,步骤②的操作有搅拌和过滤,搅拌的作用是_______.
⑵证明步骤②中已达到 Ca(OH)2溶液过量的目的,下列方案中可行的是_________.
a.取少量滤液 B,向其中通二氧化碳气体,溶液变浑浊
b.取少量溶液 B,向其中再加少量石灰水,无白色浑浊
c.取少量溶液 B,向其中再加少量浓碳酸钠溶液,有白色浑浊
⑶为获得纯净的氢氧化钠步骤③所包含的具体操作是蒸发浓缩、_________、过滤. A.蒸发结晶B.降温结晶
⑷丙同学认为乙同学流程中的 Ca(OH)2 溶液可以用稍过量的 Ba(OH)2 溶液代替,代替后的主要优点是_______________.
A.氢氧化钙微溶于水,氢氧化钡易溶于水,用氢氧化钡溶液可以减少溶液中水的量,以提高蒸发浓缩的效率,并节约能源.
B.只有氢氧化钡才能除去杂质
[实验拓展]:如何测定久置的烧碱样品中氢氧化钠的质量分数呢?
从一瓶久置的烧碱中称取了 20g,干燥后剩余固体固体质量为 19g,完全溶于蒸馏水 中配成 100g 样品溶液,现取一定溶质的质量分数的氯化钡溶液与样品溶液混合,充分反 应后得到如表所示的数据.
项目和次数 | 第 1 次 | 第 2 次 | 第 3 次 | 第 4 次 |
样品溶液质量(g) | 10 | 20 | 30 | 40 |
氯化钡溶液质量(g) | 10 | 15 | 15 | 30 |
产生沉淀的质量(g) | 1.97 | 3.94 | 3.94 | X |
⑸表中第_________次恰好完全反应.
⑹请计算样品中氢氧化钠的质量分数为_____________?(请写具体解题过程)