题目内容
有一在空气中暴露过的NaOH固体,经分析知其含水7.65%,含Na2CO3 4.32%,其余是NaOH。若将此样品1 g放入100 g3.65%的稀盐酸中充分反应,残余的酸再用10 g 30.9%的NaOH溶液恰好完全中和。将反应后的溶液蒸干,得到固体的质量是
| A.5.85 g | B.4.52 g | C.2.62 g | D.1.33 g |
A
解析试题分析:因为100g3.65%的稀盐酸与碳酸钠、氢氧化钠溶液都反应,且最终是“完全中和”,故氯元素全部与钠元素结合,生成了氯化钠。
因为100g3.65%的稀盐酸中的氯元素的质量为:100g×3.65%× ×100%=3.55g,
×100%=3.55g,
则生成的氯化钠的质量为3.55÷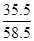 ×100%=5.85g,
×100%=5.85g,
故将反应后的溶液蒸干,得到固体的质量是5.85g。故选A
考点:质量守恒定律及其应用,化合物中某元素的质量计算
点评:本题是运用质量守恒定律中的元素守恒思想,利用化合物中某元素的质量分数来进行的计算,要想解答好这类题目,就要理解和熟记质量守恒定律及其应用,以及与之相关的知识。

练习册系列答案
 举一反三单元同步过关卷系列答案
举一反三单元同步过关卷系列答案
相关题目