题目内容
【题目】某研究性学习小组设计了测定纯碱(Na2CO3)样品(只含NaCl杂质)中Na2CO3质量分数的实验方案.请回答下列问题:
小资料:碱石灰的主要成分是氢氧化钠和氧化钙的混合物
(1)气体法。
【原理思路】利用Na2CO3与稀硫酸反应产生CO2,通过测量丙装置实验前后的质量得出CO2质量,从而计算碳酸钠的质量分数。(不考虑原装置内空气的影响)
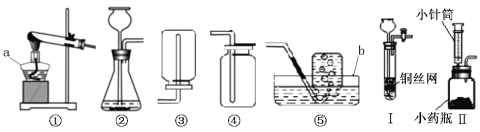
【实验分析】小科同学根据以上思路,设计了如下图的实验装置。
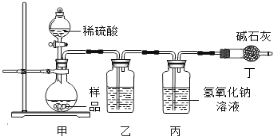
①实验装置乙中盛放的试剂为 。
装置丁中碱石灰的作用是 。(填字母)
A.吸收Na2CO3与稀硫酸反应产生CO2
B.防止外界空气中二氧化碳进入丙中
C.干燥二氧化碳
②实验中如果滴加稀硫酸的速度过快,会导致测得样品中碳酸钠的
质量分数 (填写“偏高”“偏低”或“不变”).
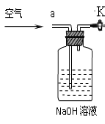
③小明同学认为小科的方案存在问题,即使操作规范下也会造成结果偏低,你认为他的理由是 ,应该将装置甲中双孔橡胶塞换成三孔橡胶塞,并增加下图装置,实验结束后缓缓通入一段时间空气,目的是 ,其中NaOH溶液的作用是 。
(2)沉淀法.
【实验原理】利用碳酸根离子与钙离子结合生成沉淀,通过沉淀的质量而得出碳酸钠的质量分数。
【实验步骤】①用托盘天平称取样品11.0g放入烧杯中,加水使其完全溶解;
②加入过量的CaCl2溶液充分反应。证明CaCl2过量(即Na2CO3已完全反应)的方法是: 静置,向上层清液中滴加 溶液,如果没有白色沉100%=96.4%淀生成,证明CaCl2过量;
③过滤、操作X、干燥、称量沉淀的质量为10.0g,操作X的名称是 ,如果缺少此操作会造成碳酸钠质量分数 (填写“偏高”“偏低”或“不变”)。
④通过以上提供的数据计算出样品中碳酸钠的质量分数为 。(写出计算过程,结果保留至0.1%)
【答案】(1)①浓硫酸 ;B; ②偏低;③有二氧化碳残留在烧瓶中;将残留的二氧化碳全部鼓入到丙装置,使其完全被氢氧化钠吸收;吸收空气中的二氧化碳;(2)②氯化钙;③洗涤;偏高;④96.4%
【解析】
试题分析:为了测定纯碱(Na2CO3)样品(只含NaCl杂质)中Na2CO3质量分数:(1)气体法.
【实验分析】根据图1的实验装置.则可推测:①实验装置乙中盛放的试剂为浓硫酸(或浓H2SO4),其作用是吸收水蒸气(或干燥CO2);装置丁中碱石灰的作用是防止外界空气中二氧化碳进入丙中,对实验结果造成干扰.②实验中如果滴加稀硫酸的速度过快,因为碳酸根不能充分与稀硫酸反应,则会导致测得样品中碳酸钠的质量分数偏低.③如果有CO2残留在烧瓶内,也会造成结果偏低,故应该将装置甲中双孔橡胶塞换成三孔橡胶塞,并增加图2装置,实验结束后缓缓通入一段时间空气,目的是将残留的CO2全部鼓入到并装置中,使其完全被氢氧化钠溶液吸收,其中NaOH溶液的作用是吸收空气中的CO2.(2)沉淀法.【实验原理】利用碳酸根离子与钙离子结合生成沉淀,通过沉淀的质量而得出碳酸钠的质量分数.【实验步骤】①用托盘天平称取样品11.0g放入烧杯中,加水使其完全溶解;②加入过量的CaCl2溶液充分反应.证明CaCl2过量(即Na2CO3已完全反应)的方法是:静置,向上层清液中滴加CaCl2溶液,如果没有白色沉淀生成,证明CaCl2过量;③过滤、洗涤、干燥、称量沉淀的质量为10.0g,如果缺少洗涤会造成碳酸钠质量分数偏高.
④设样品中碳酸钠的质量为x
Na2CO3+CaCl2==CaCO3↓+2NaCl
100
X 10.0g
106:100=X:10.0g
X=10.6g
碳酸钠的质量分数为10.6g/11.0g×100%=96.4%

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】(9分)某面包膨松剂由碳酸氢钠和碳酸氢铵两种物质组成。化学小组为验证该膨松剂的成分及各成分含量的测定,通过查阅资料,设计如图所示实验。

查阅资料:①膨松剂在面包制作过程中发生的两个化学反应的方程式分别是:
2NaHCO3 △ Na2CO3+H2O+CO2↑
NH4HCO3 △ NH3↑+H2O+CO2↑
②通常状况下,1体积水溶解700体积氨气,氨气溶于水所得溶液为氨水
③二氧化碳溶于水,溶液呈酸性
实验定性验证:
操 作 步 骤 | 实 验 现 象 | 实 验 结 论 |
组装仪器, | ||
装入药品进行加热,打开阀 门 、关闭阀门 。 | 观察到 | 则说明有碳酸氢铵存在 |
然后打开阀门K2、关闭阀门 K1继续加热 | 最终观察到B中试管内没有气泡冒出,且____________ 。 | 则说明有碳酸氢钠存在 |
实验分析及反思:(1) 同学甲认为应将装置B中水换成澄清石灰水,才能判断样品的成分。
同学乙认为没有必要,他的理由是 。
(2) 请你分析装置C中碱石灰的作用是 。
实验数据分析及成分含量计算:
小组同学利用电子天平共同作了以下测定实验,实验数据记录如下:
称量项目 | 称量 时间 | 质量(g) |
装置A中试管质量 | 反应前 | 50.00 |
装置A中试管+样品质量 | 反应前 | 70.00 |
装置A中试管+固体质量 | 反应后 | 60.60 |
请你分析表中实验数据并计算该膨松剂中碳酸氢铵的质量分数。(写出计算的详尽过程)
解: