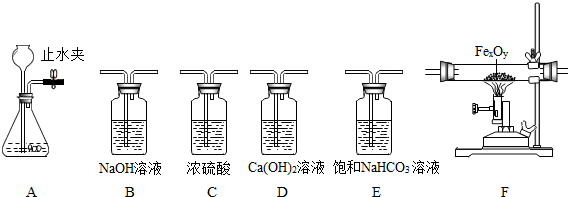
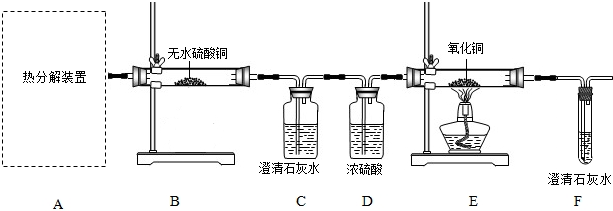
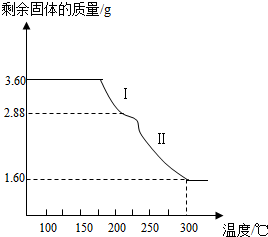
题目内容
铁的氧化物化学式有FeO、Fe2O3,Fe3O4三种,其中氧化亚铁是________.
FeO
分析:根据在化合物中正负化合价代数和为零,亚铁离子的化合价为+2价,分析铁的三种氧化物的化合价即可解答.
解答:根据在化合物中正负化合价代数和为零,氧元素的化合价为-2价,
化学式FeO中Fe 的化合价为x,x+(-2)=0,解得 x=+2;
化学式Fe2O3,中Fe 的化合价为y,2y+(-2)×3=0,解得 y=+3;
化学式Fe3O4中Fe 的化合价为y,3z+(-2)×4=0,解答 z=+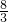 ;
;
由此可知氧化亚铁是 FeO;故答案为:FeO.
点评:本题考查学生根据在化合物中正负化合价代数和为零的原则进行解题的能力.
分析:根据在化合物中正负化合价代数和为零,亚铁离子的化合价为+2价,分析铁的三种氧化物的化合价即可解答.
解答:根据在化合物中正负化合价代数和为零,氧元素的化合价为-2价,
化学式FeO中Fe 的化合价为x,x+(-2)=0,解得 x=+2;
化学式Fe2O3,中Fe 的化合价为y,2y+(-2)×3=0,解得 y=+3;
化学式Fe3O4中Fe 的化合价为y,3z+(-2)×4=0,解答 z=+
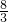 ;
;由此可知氧化亚铁是 FeO;故答案为:FeO.
点评:本题考查学生根据在化合物中正负化合价代数和为零的原则进行解题的能力.

练习册系列答案
 赢在课堂名师课时计划系列答案
赢在课堂名师课时计划系列答案
相关题目