题目内容
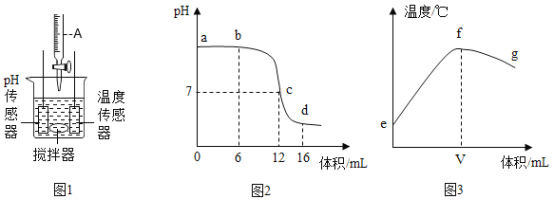
【题目】小张同学利用图 1 装置研究稀盐酸与氢氧化钠溶液反应的过程,并用 pH 和温度传感器测量反应过程中相关物理量的变化情况,记录得到图 2 和图 3。
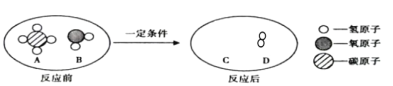
据此,小张同学得到以下结论:
①图 1 的仪器 A 中盛放的是氢氧化钠溶液;
②图 2 中 b 点所示溶液中的溶质是 NaCl 和 NaOH;
③将图 2 中 d 点所示溶液加热蒸干所得固体为纯净物;
④图 2 中 c→d 所示溶液中 NaCl 的质量不断增加;
⑤图 3 中 V 的数值最接近 12;
⑥由图 3 中 e→f 的变化趋势可说明该反应是放热反应。 以上描述中,正确的是:
A.①④⑥B.②④⑤⑥C.②③⑤⑥D.②③④⑤⑥
【答案】C
【解析】
①:结合图2可知,溶液起点的pH值大于7,表示溶液呈碱性,溶液是氢氧化钠溶液,仪器A中是稀盐酸,故①错误;
②:由①可知,该实验是向氢氧化钠溶液中滴入稀盐酸,在图2b点,溶液仍显碱性,说明滴入的稀盐酸与氢氧化钠反应生成了氯化钠,此时溶液中氢氧化钠还有剩余,溶质是氯化钠和氢氧化钠,故②正确;
③:图2d点溶液pH值小于7,溶液为酸性,说明稀盐酸过量,此时氢氧化钠全部与盐酸反应生成了氯化钠,盐酸具有挥发性,蒸发过程中会除去,结晶后得到氯化钠固体,是纯净物,故③正确;
④:c点pH值等于7溶液呈中性,说明此时氢氧化钠与加入的稀盐酸完全反应,d点pH小于7,说明从c到d一直在滴入盐酸,但因氢氧化钠在c点时已经全部反应,此时不会有氯化钠产生,氯化钠质量不会增加,④错误;
⑤:c 点对应加入盐酸的体积是12mL,此时酸和碱恰好中和,此时反应放出的热量最多,故⑤正确;
⑥:从图 3 中看到随着盐酸加入溶液的温度有一段升高的过程,说明反应放热,故⑥正确。
结合以上分析,可知①④错误,②③⑤⑥正确,故本题答案选C。

 特高级教师点拨系列答案
特高级教师点拨系列答案【题目】硫酸是一种重要的化工原料,也是实验室中常用的化学试剂。某兴趣小组对硫酸的性质、制取、用途等方面的探究,请你共同参与并回答有关问题。
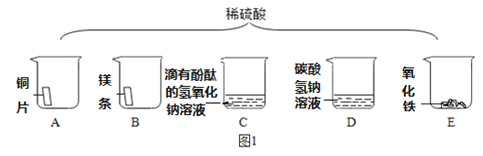
(探究一)硫酸的性质
(1)如图1将足量的稀硫酸分别加入A~E五只烧杯中。无现象的是_____________(填序号)。
(2)烧杯C中的现象是红色褪去,反应后溶液中溶质是什么呢?(无色酚酞不考虑)
(猜想)猜想一:只有Na2SO4 ; 猜想二:有_________________;
(3)为了验证猜想,小组同学取烧杯中的溶液,并选用老师提供的pH试纸、BaC12溶液、Na2CO3溶液,分别进行如下三组探究实验。
实验方案 | 测溶液pH | 滴加Na2CO3溶液 | 滴加BaCl2溶液 |
实验操作 |
|
|
|
实验现象 | 试纸变色,比照比色卡,pH<7 | ____________ | 产生白色沉淀 |
实验结论 | 溶液中有H2SO4 | 溶液中有H2SO4 | 溶液中有H2SO4 |
(得出结论)通过探究,小组同学一致确定猜想二是正确的。
(评价反思)老师指出上述三个实验探究中存在两处明显错误,请大家反思。同学们经过反思发现了这两处错误:
①实验操作中明显的一处错误是_________________________________________;
②实验探究方案中也有一个是不合理的,不合理的原因是____________________________。
(探究二)硫酸的工业制法
工业上以黄铁矿(主要成分是FeS2)为原料生产硫酸的工艺流程如图所示,其中沸腾炉内发生的主
要反应是: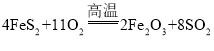

(1)接触室中发生的化学方程式为_________________________________________。
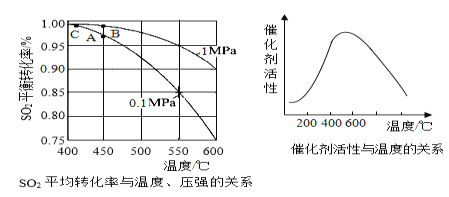
(2)接触室中的SO2平衡转化率与温度及压强的关系如下图所示,催化剂活性与温度的关系如图所示。在实际生产中,SO2催化氧化反应的条件选择常压和450℃(对应图中A点),而没有选择SO2转化率更高的C点对应的反应条件,其原因是___________________________________。
(探究三)探究某黄铁矿中FeS2的含量。
(查阅资料)![]()
(实验探究)Ⅰ称取1.60g黄铁矿样品放入如图所示装置(夹持装置省略)的石英管中,从a处不断地缓缓通入空气、高温灼烧石英管中的黄铁矿样品至完全反应(同工业上沸腾炉内的反应)。

Ⅱ反应结束后,将乙瓶中的溶液进行如下图处理。

(问题讨论)I中装置甲瓶内盛放的试剂是氢氧化钠溶液,其作用是_____________________。
(含量测定)计算该黄铁矿中FeS2的质量分数为_______________。(写出计算过程)