题目内容
(7分)某地盛产石灰石,石灰石的主要成分是碳酸钙,某节课上同学们对碳酸钙高温加热一段时间剩余固体的成分进行了探究。
【提出问题】剩余固体成分是什么?
【猜想与假设】A全部是碳酸钙 B C碳酸钙和氧化钙的混合物
【设计并完成实验】请填写(1)中结论和(2)中的实验步骤及实验现象
| 实验操作 | 实验现象 | 实验结论 |
| (1)取少量固体于试管中,加适量水振荡后静置,再滴几滴无色酚酞试液。 | 溶液变红 | 剩余固体成分中一定含有 。(填化学式) |
| (2) | | 剩余固体成分中一定含有碳酸钙。 |
【讨论交流】有同学提出证明实验(1)的结论可用“取少量固体于试管中,加适量水振荡,直接通入CO2,看溶液是否变浑浊”的方案也行。你是否赞成他的观点, 原因是
【猜想与假设】全部是氧化钙(1分)【设计并完成实验】(1)CaO(1分)(2)取少量固体于试管中,加适量稀盐酸,观察现象。(1分)有大量气泡产生(1分)【实验结论】C;【讨论交流】不赞成(1分)CaO与水反应生成的Ca(OH)2微溶于水,溶液变浑浊不能说明是CO2与Ca(OH)2反应的产物所致。
解析

某实验小组的同学用氢氧化钙和盐酸进行酸碱中和的实验时,向烧杯中的氢氧化钙溶液加入稀盐酸,实验结束后,发现忘了滴加指示剂。他们停止滴加稀盐酸,并对烧杯内溶液中的溶质成分进行探究。
(1)复分解反应的发生需要一定的条件。氢氧化钙和盐酸能发生复分解反应是因为
。
(2)探究烧杯中溶液中溶质的成分。
【提出问题】该烧杯内溶液中的溶质是什么?
【猜想】猜想一:可能是Ca(OH)2和CaCl2;猜想二:可能只有CaCl2
猜想三:可能是 。
【查阅资料】 CaCl2溶液显中性。
【进行实验】
实验一:取少量烧杯内溶液于试管中,滴入几滴酚酞溶液,振荡,若
说明猜想一不正确。
实验二:另取烧杯内的少量溶液于另一只试管中,逐滴加入碳酸钠溶液至过量,若
,说明猜想二不正确,猜想三正确。
实验三:取少量烧杯内溶液于试管中,用下列物质中的 (填序号)不能说明
猜想三正确。
| A.紫色石蕊 | B.氢氧化铜 | C.硝酸银 | D.锌 |
① 在分析化学反应后所得物质成分时,除考虑生成物外还需考虑 。
② 要处理烧杯内溶液,使其溶质只含有CaCl2,应向烧杯中加入过量的 。
③ 实验室欲中和100g 7.3% 的盐酸,至少需要多少克熟石灰?
化学实验中常出现意外情况,要根据具体情况区别对待,善于发现和解决问题。例如:
①做细铁丝在氧气中燃烧的实验时,集气瓶底部破裂。可能的一个原因是 (27) 。
②用下图所示的简易启普发生器制取二氧化碳时,若收集了一定量气体后夹紧b,c内反应物固体与液体无法分开,可能的一个原因是 (28) 。
③某同学向Na2CO3溶液中滴加BaCl2溶液,发现冒气泡,则BaCl2溶液中 可能混有的杂质是 (29)
A.盐酸 B.硫酸 C.碳酸钠
④用盐酸和碳酸钙固体反应,将得到的气体X通入澄清石灰水中,始终没有发现石灰水变浑浊(装置气密性良好)。
【提出假设】假设一:澄清石灰水已变质;
假设二:气体X中除了有CO2外,还有(30)
【实验探究】用下图所示实验探究上述假设是否合理。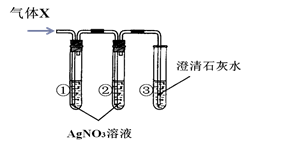
【现象与结论】
| 实验 | 现象 | 分析与结论 |
| 一 | 若:试管①中(31) , 试管②中无明显变化, 试管③中液体变浑浊。 | 试管③中发生反应的化学方程式为(32) , 结论:假设二成立。 |
| 二 | 若:试管①中出现白色沉淀, 试管②中无明显变化, 试管③中无明显变化。 | 试管②中试剂的作用是(33) , 结论:(34) 成立 |
(8分)有位化学教师取用生石灰时,发现装满生石灰的塑料试剂瓶已经膨胀破裂,于是请同学们进行了如下探究:
(1)取一定量样品于烧杯中,加入适量的水充分搅拌,用手触摸烧杯外壁,无明显现象。由此说明该样品中不含有 ;
(2)对该样品成分进行了如下猜想:
猜想① Ca(OH)2 猜想② Ca(OH)2和 CaCO3的混合物 猜想③ CaCO3
以下是某同学对猜想②进行的探究,请你补充完成实验报告
| 实验操作 | 预期现象与结论 |
| | , 说明固体中含有Ca(OH)2。 |
| | , 说明固体中含有CaCO3。 |
(5分)现有一瓶遗失标签的白色固体,是碳酸钡、碳酸钾和氯化钠三种的一种。为了确定该固体是何种固体,小仪同学进行了如下的实验:
她取了少量的固体到试管中,加入足量水振荡,通过观察实验现象,她很快断定不是碳酸钡,她观察到的现象是 ;
为进一步确定该固体是何种物质,请你帮助小仪设计一个实验方案,并完成实验报告。
| 实验步骤(可图示,需简要说明) | 预期现象和结论 |
| | |
(7分)四氧化三铁可用于医疗器械、电子等工业。某实验兴趣小组从工厂采集废液(含FeSO4和少量ZnSO4、MgSO4),进行四氧化三铁的制备实验。
【阅读资料】
(1)25℃时,氢氧化物沉淀的pH范围如表所示。
| | Zn(OH)2 | Fe(OH)2 | Mg(OH)2 |
| 开始沉淀的pH | 5.7 | 7.6 | 10.4 |
| 沉淀完全的pH | 8.0 | 9.6 | 12.4 |
(3)制备Fe3O4的实验流程如下:

【回答问题】
(1)往废液中加入氢氧化钠溶液生成沉淀的化学方程式为 (写出其中一个)。
(2)操作a的名称为 。该操作需要的玻璃仪器有烧杯、玻璃棒、 等。玻璃棒在此操作中的主要作用是 。
(3)溶液1所含溶质有 (至少写两种成分的化学式);溶液3所含溶质的主要成分为 (写名称)。
炎热的六月,同学们在帮老师整理实验室时,发现一瓶久置石灰水试剂瓶的瓶壁和瓶塞周围有一些白色粉末。为弄清楚白色粉末的成分及其成因,他们进行了如下探究:
【提出问题】白色粉末的成分是什么?
【进行猜想】
猜想一:CaCO3
猜想二:CaCO3和Ca(OH)2
猜想三:Ca(OH)2(因为气温较高,溶质 或溶剂蒸发,使石灰水中的溶质析出)
【设计实验】
(1)甲同学取白色粉末装入试管中,加入少量的水,振荡,发现有白色固体不溶解,于是他认为猜想一正确。乙同学认为甲同学的结论不严密,理由是: 。
(2)为了得出较严密的结论,他们进行了如下实验。请完成下列实验报告:
| 实验步骤 | 可能观察到的现象 | 结论 |
| 取(1)试管中的上层清液,向其中滴加酚酞试液 | | 猜想一正确 |
| 取(1)试管中的残留固体,向其中加入 | 有气泡生成 |
(1)假设猜想二正确,利用上面表格中的步骤进行实验,出现的现象是
。
(2)通过上述实验探究,同学们向实验室提出保存和使用此类溶液的下列建议中,合理的是 。
A.密封保存 B.禁止使用这种试剂 C.敞口放置 D. 使用前,临时配制
(3)用化学方法除去瓶壁上的白色固体(用化学方程式表示):
。
某化学兴趣小组在帮助整理化学实验室时,发现一瓶久未盖上瓶塞的氢氧化钠溶液。该小组同学对该瓶氢氧化钠溶液产生浓厚的兴趣,决定研究并证明该瓶溶液是否变质。
[提出猜想] 猜想一:该瓶氢氧化钠溶液未变质。
猜想二:该瓶氢氧化钠溶液完全变质。
猜想三:该瓶氢氧化钠溶液 。
[初步证明] 该小组的同学认为猜想一是 的(填“正确”或“错误”),
其原因是: 。
[设计方案] 同学们设计以下实验方案来证明氢氧化钠溶液是否变质,通过查阅资料可知氢氧化钠溶液变质是生成碳酸钠。
| 实 验 操 作 | 实 验 现 象 | 实 验 结 论 |
| 取少量该瓶的氢氧化钠溶液于试管中,加入适量a: | b: | 该氢氧化钠溶液已经变质 |
[拓展思维] 1.氢氧化钠固体暴露在空气中容易吸收水分而 ,因而氢氧化钠固体与生石灰混合后可用作某些气体的 。
2.以上所述可以得出,氢氧化钠的保存方法是: 。

