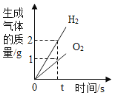
题目内容
【题目】乙酸(俗称醋酸)是我们生活中常见的一种饱和脂肪酸,下表列举了部分饱和脂肪酸的化学式、熔点和沸点,请你根据表中信息回答下列问题:
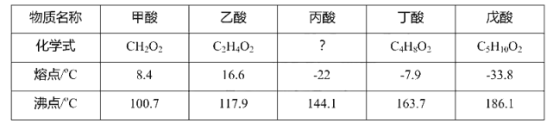
(1)试推测丙酸的化学式为__________;
(2)饱和脂肪酸的命名与分子中的______原子个数有关;
(3)这五种饱和脂肪酸中氢元素的质量分数最大的是________(填物质名称);
(4)乙酸的水溶液中会含有较多的氢离子,则![]() 个氢离子可以表示为_______(填化学符号);
个氢离子可以表示为_______(填化学符号);
(5)甲酸与浓硫酸共热,常用于实验室制取一氧化碳,其化学方程式可以表示为: HCOOH![]() H2O+CO该反应所属的基本反应类型是___________.
H2O+CO该反应所属的基本反应类型是___________.
(6)下列有关戊酸的说法正确的是_______(填序号)
A.戊酸是由原子构成的 B.戊酸中含有氧分子
C.戊酸属于氧化物 D.戊酸分子中碳、氢、氧原子的个数比为5:10:2
【答案】C3H6O2 碳 戊酸 nH+ 分解反应 D
【解析】
(1)由甲酸、乙酸、丁酸和戊酸的化学式可推知,饱和脂肪酸的化学式通式为:CnH2nO2,所以丙酸的化学式为C3H6O2;
(2)由表格中五种饱和脂肪酸的化学式与命名方法可知,饱和脂肪酸的命名与分子中的碳原子个数有关;
(3)五种饱和脂肪酸中,氢元素与其相对分子质量之比依次为:
甲酸:(1×2):(12+1×2+16×2)=1:23;
乙酸:(1×4):(12×2+1×4+16×2)=1:15;
丙酸:(1×6):(12×3+1×6+16×2)=3:37;
丁酸:(1×8):(12×4+1×8+16×2)=1:11;
戊酸:(1×10):(12×5+1×10+16×2)=5:51。可见,戊酸中氢元素的质量分数最大;
(4)离子的表示方法是在表示该离子的元素符号右上角,标出该离子所带的正负电荷数,数字在前,正负符号在后,带1个电荷时,1要省略。则n个氢离子可以表示为nH+;
(5)由化学方程式可知,该反应的反应物是一种,生成物是两种,属于分解反应;
(6)A、戊酸是由戊酸分子构成的,不是由原子直接构成的,故A错误;
B、戊酸是由戊酸分子构成的,每个戊酸分子中含有2个氧原子,不含氧分子,故B错误;
C、氧化物是由两种元素组成的化合物,戊酸是由三种元素组成的,不属于氧化物,故C错误;
D、由戊酸的化学式C5H10O2可知,戊酸分子中碳、氢、氧原子的个数比为5:10:2,故D正确。故选D。

【题目】请从微观角度分析下列现象
(1)使用体温计测体温。________
(2)古代字画能够保存很长时间不褪色________。
(3)盐酸和碳酸钠反应前后质量不等为什么遵守质量守恒定律________?
【题目】下列实验中,相关实验现象的描述错误的是
镁条在空气中燃烧 |
测定空气中氧气含量 |
木炭在氧气中燃烧 |
CO2通入石蕊试液中 |
A、产生耀眼的白光、生成黑色固体 | B、产生大量白烟;集气瓶内液面上升约至刻度“1” | C、发白光、石灰水变浑浊 | D、紫色石蕊试液变红色 |
A. AB. BC. CD. D
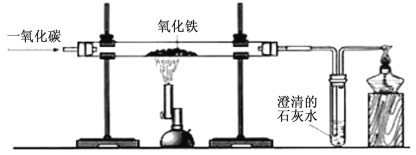
【题目】在学完氧气的性质后,某校课外小组同学对铁与氧气的反应进行了更深入地研究。
(1)实验1:在燃着的酒精上方抖落铁粉,观察到火星四射,如图所示。

①铁丝在空气中不能燃烧,铁粉却能在空气中燃烧,由此说明在某些工业生产中将原料粉碎的目的是________。
②铁丝在空气中不能燃烧,在氧气中能燃烧,其燃烧的化学反应方程式为________。
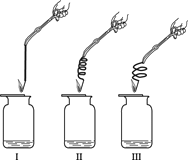
(2)实验2:用排水法收集等量的氧气作如下图所示实验,实验中所用的3根铁丝均从同1根长铁丝上截取,并且长度相同。
实验装置 | 实验现象 |
| 铁丝均燃烧,剧烈程度不同,Ⅱ最剧烈,其次是Ⅲ,较弱的是Ⅰ。 |
①若实验中集气瓶底部不预留少量水,则可能造成的结果是________。
②绕成螺旋状的铁丝比直铁丝燃烧剧烈的原因是________。
A. 绕成螺旋状的铁丝着火点降低
B. 绕成螺旋状的铁丝与O2接触面积大
C. 绕成螺旋状的铁丝能够更好地聚热,预热效果好
(3)实验3:用排水法收集等量的氧气,取不同型号的铁丝进行实验(铁丝的长度、绕成的螺旋圈数等相同)。
小资料:型号为304L、304、302铁丝,含碳量分别约为 0.03%、0.08%、0.15%。
铁丝种类 | 实验现象 |
304L | 轻微火星四射 |
304 | 明显的火星四射 |
302 | 剧烈的火星四射 |
由该实验可得到的结论是________。
(4)对于铁与氧气的反应,你还想研究的问题是_________。