题目内容
【题目】将质量相等,表面积相同的锌片和镁片分别加入到完全相同的两份稀盐酸中,反应速率随时间变化的关系如图所示,反应后两种金属都有剩余,下列说法错误的是
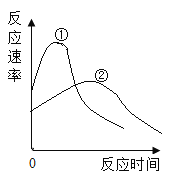
A.曲线②表示的是锌与稀盐酸反应速率的变化
B.两种金属和稀盐酸反应最终产生的氢气质量相等
C.镁和稀盐酸反应速率快是因为镁的相对原子质量小
D.刚开始时反应速率都变快是因为反应放热
【答案】C
【解析】
A、金属的活动性越强,反应越快,根据金属的活动性:镁>锌,则曲线②表示的是锌与稀盐酸反应速率的变化,故选项正确,不符合题意;
B、反应后两种金属都有剩余,两种金属与稀盐酸反应消耗稀盐酸的质量相等,所以最终产生的氢气质量相等,故选项正确,不符合题意;
C、金属的活动性越强,反应越快,根据金属的活动性:镁>锌,所以镁和稀盐酸反应速率快,故选项错误,符合题意;
D、金属与酸反应都会放出热量,所以刚开始时反应速率都变快,故选项正确,不符合题意。
故选C。

练习册系列答案
相关题目