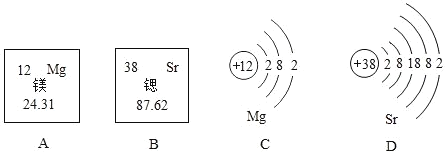
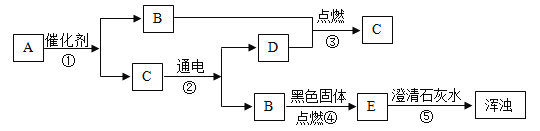
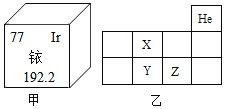
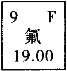
题目内容
【题目】"84"消毒液可用于灾区防疫,其主要成分是次氢胺钠(NaCIO),制取它的化学方程式为![]() ,则X的化学式为_____,次氯酸钠中,钠的化合价为+1价,氧的化合价为-2价,则氯的化合价为_____。
,则X的化学式为_____,次氯酸钠中,钠的化合价为+1价,氧的化合价为-2价,则氯的化合价为_____。
【答案】Cl2 +1
【解析】
由质量守恒定律:反应前后,原子种类、数目均不变,由反应的化学方程式2NaOH+X═NaClO+NaCl+H2O,反应前钠、氧、氢原子个数分别为2、2、2,反应后的生成物中钠、氧、氢、氯原子个数分别为2、2、2、2,根据反应前后原子种类、数目不变,则每个X分子由2个氯原子构成,则物质X的化学式为Cl2.
钠元素显+1价,氧元素显-2价,设氯元素的化合价是x,根据在化合物中正负化合价代数和为零,可得:(+1)+x+(-2)=0,则x=+1价;
故答案为:Cl2;+1。

 名师伴你成长课时同步学练测系列答案
名师伴你成长课时同步学练测系列答案【题目】彩漂洗衣液能够去溃、除菌,对白色织物的去渍效果尤佳。同学们在对其研究时发现其中含有过氧化氢,查阅资料后得知过氧化氢溶液具有漂白性,可漂白一些有色物质,实验小组对过氧化氢的性质进行了探究。
Ⅰ.不稳定性
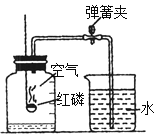
过氧化氢在常温下便能分解,因此盛放过氧化氢溶液的试剂瓶内壁会有一些微小的气泡,其发生反应的化学方程式是_______________,实验小组的同学向该过氧化氢溶液中加人了少量氧化铁,发现产生气泡的速度变快了,该实验_______(能、不能)说明氧化铁是过氧化氢分解的催化剂。
Ⅱ.漂白性

[提出问题]过氧化氢的漂白性与哪些因素有关?
[进行猜想]通过阅读相关资料,你认为过氧化氢的漂白性可能与________、________等因素有关。
[进行实验]
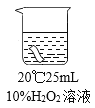
实验1:室温下用10%的过氧化氢溶液浸泡一块红色布条,浸泡时间与布条颜色变化
如下表:
浸泡时间 | 20 min | 40min | 60 min |
布条颜色的变化 | 无明显变化 | 颜色稍变浅 | 颜色明显变浅 |
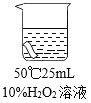
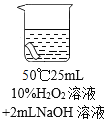
实验2:将红色布条分别浸泡在以下3种溶液中,现象如下表。
编号 | ① | ② | ③ |
实验 |
|
|
|
布条颜色 |
| 颜色稍变浅 | 颜色明显变浅 |
[解释与结论]
(1)实验1的目的是__________________。
(2)实验2中,欲得出“其它条件相同时,升高温度可使过氧化氢溶液的漂白性增强”的结论,需要对比实验_________________(填编号)。
(3)实验2中,通过对比②③得出的结论是:其它条件相同时,___________。
(4)根据上述实验,推测“使用彩漂液时水温不宜超过50C”的原因是___________________。