题目内容
【题目】电解食盐水可得到烧碱、氯气(Cl2)和一种可燃性气体,反应的化学方程式为;配制质量分数为5%的氯化钠溶液,若量取水时俯视量筒刻度读数(其他操作正确),溶液的质量分数5%(填“大于”、“小于”或“等于”);现有NaCl和NaBr的混合物共2.2g,溶于水并加入过量的AgNO3溶液后,生成AgCl和AgBr沉淀共4.75g,则原混合物的含钠元素的质量为g.
【答案】2NaCl+2H2O ![]() 2NaOH+H2↑+Cl2↑;大于;0.69
2NaOH+H2↑+Cl2↑;大于;0.69
【解析】解:(1)电解食盐水可得到烧碱、氯气(Cl2)和一种可燃性气体,根据现有已知物质配平可得2NaCl+2H2O ![]() 2NaOH+H2↑+Cl2↑,可燃性气体为氢气.(这个配平可以用氯元素下手,进而氯化钠的系数为2,氢氧化钠的也为2,则水的系数为2,进而得到氢原子缺少两个,而为氢气);,所以化学方程式为 2NaCl+2H2O
2NaOH+H2↑+Cl2↑,可燃性气体为氢气.(这个配平可以用氯元素下手,进而氯化钠的系数为2,氢氧化钠的也为2,则水的系数为2,进而得到氢原子缺少两个,而为氢气);,所以化学方程式为 2NaCl+2H2O ![]() 2NaOH+H2↑+Cl2↑;(2)配制质量分数为5%的氯化钠溶液,若量取水时俯视量筒刻度读数(其他操作正确),则量取的水少了,也就导致溶液浓了,即溶液的质量分数大于5%;(3)混合物中氯化钠和溴化钠和过量的硝酸银反应得到的是氯化银和溴化银,所以质量差量是钠转化为银所致. 设钠元素的质量为a(统一阴离子为X,对应的相对原子质量为x);则有
2NaOH+H2↑+Cl2↑;(2)配制质量分数为5%的氯化钠溶液,若量取水时俯视量筒刻度读数(其他操作正确),则量取的水少了,也就导致溶液浓了,即溶液的质量分数大于5%;(3)混合物中氯化钠和溴化钠和过量的硝酸银反应得到的是氯化银和溴化银,所以质量差量是钠转化为银所致. 设钠元素的质量为a(统一阴离子为X,对应的相对原子质量为x);则有
Na∽∽~ | NaX~~~~ | AgX(沉淀) | 固体质量增加为 |
23 | 23+x | 108+x | 108-23=85 |
a | 4.75g﹣2.2g=2.55g |
![]() =
= ![]()
a=0.69g
所以答案是:2NaCl+2H2O ![]() 2NaOH+H2↑+Cl2↑; 大于 0.69.
2NaOH+H2↑+Cl2↑; 大于 0.69.
【考点精析】解答此题的关键在于理解书写化学方程式、文字表达式、电离方程式的相关知识,掌握注意:a、配平 b、条件 c、箭号,以及对根据化学反应方程式的计算的理解,了解各物质间质量比=系数×相对分子质量之比.

 百分学生作业本题练王系列答案
百分学生作业本题练王系列答案【题目】根据问题填空:
(1)以下是有关CO2气体溶解度的几组数据: CO2在水中的溶解度(单位:mL)
压强/大气压 | 温度/℃ | ||||
0 | 25 | 50 | 75 | 100 | |
1 | 1.79 | 0.752 | 0.423 | 0.307 | 0.231 |
10 | 15.92 | 7.14 | 4.095 | 2.99 | 2.28 |
25 | 29.30 | 16.20 | 9.71 | 6.82 | 5.73 |
①根据CO2在水中的溶解度表,叙述外界条件是如何影响气体溶解度的?、 .
②打开可乐瓶有气体溢出,说明原瓶中的压强(填:大于、小于或等于)瓶外大气压强.
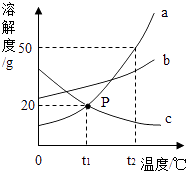
(2)如图是无结晶水合物的固体甲和乙在水中的溶解度曲线,请根据该曲线图回答下列问题: 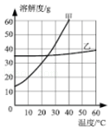
①20°C时,150g水中溶解g甲物质才能形成饱和溶液.
②现有60℃的乙的饱和溶液,与该溶液有关的量有:
A.水的质量
B.溶液中溶质的质量
C.溶液的质量
D.乙的质量分数
E.60℃时乙的溶解度
保持温度不变,将该饱和溶液稀释,不变的量是(填序号,下同);如果将该饱和溶液降温至20℃,不变的量是 .