题目内容
【题目】某钢铁厂实验室为测定赤铁矿Fe2O3的含量,将矿石粉碎(其中杂质既不溶于水也不与酸反应),进行如下实验: 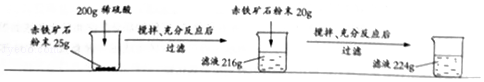
请回答下列问题:
(1)上述实验过程中发生反应的化学方程式为;
(2)样品中Fe2O3的质量分数是;
(3)根据已知条件列式求解200g稀硫酸中溶质质量(x)的比例式;
(4)若向最终滤液中加入16g水,所得不饱和溶液中溶质的质量分数为;
(5)该钢铁厂每天用上述赤铁矿石1900t来生产生铁,则理论上日产含杂质5%的生铁的质量为 .
【答案】
(1)Fe2O3+3H2SO4═Fe2(SO4)3+3H2O
(2)64%
(3)![]() =
= ![]() 或者
或者 ![]() =
= ![]()
(4)25%
(5)896t
【解析】解:上述实验过程中,氧化铁和稀硫酸反应生成硫酸铁和水,发生反应的化学方程式为:Fe2O3+3H2SO4═Fe2(SO4)3+3H2O.根据化学方程式可知,溶液的质量增加量也就是参加反应的氧化铁的质量. 加入25g赤铁矿时,溶液质量增加了16g,而再加20g赤铁矿,按照前面的比例如果酸足量,则应该溶液增加12.8g而得到216g+12.8g=228.8g溶液,现在只得到224g,说明铁矿石没有完全反应,而硫酸完全反应了,此时反应的氧化铁的质量为224g﹣200g=24g.
应该以第一次加入赤铁矿时的数据计算样品中氧化铁的质量分数;
样品中Fe2O3的质量分数是: ![]() ×100%=64%,
×100%=64%,
根据分析可知,200g硫酸与24g氧化铁恰好反应.
设200g硫酸中溶质的质量为x,生成的硫酸铁的质量为y
Fe2O3+ | 3H2SO4═ | Fe2(SO4)3+3H2O |
160 | 294 | 400 |
24g | x | y |
![]() =
= ![]() =
= ![]()
x=44.1g
y=60g
若向最终滤液中加入16g水,所得不饱和溶液中溶质的质量分数为 ![]() ×100%=25%;
×100%=25%;
该钢铁厂每天用上述赤铁矿石1900t来生产生铁,则理论上日产含杂质5%的生铁的质量为1900t×64%× ![]() ×100%÷(1﹣5%)=896t.
×100%÷(1﹣5%)=896t.
故填:(1)Fe2O3+3H2SO4═Fe2(SO4)3+3H2O;(2)64%;(3) ![]() =
= ![]() 或者
或者 ![]() =
= ![]() ;(4)25%;(5)896t.
;(4)25%;(5)896t.
【考点精析】通过灵活运用根据化学反应方程式的计算,掌握各物质间质量比=系数×相对分子质量之比即可以解答此题.

 阅读快车系列答案
阅读快车系列答案