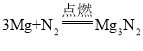题目内容
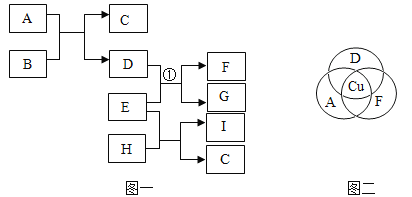
【题目】A-H 是初中化学中的常见物质。请结合它们之间的转化关系图,回答下列问 题。(图中“→”表示物质间存在转化关系,“—”表示相互反应)
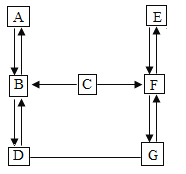
①A 在标准状况下是密度最小的气体,A 的化学式是_____;A、 C 中含有同一种元素,C→B 时溶液呈黄色,由此推断与 C 反应 生成 B 的物质是_____;
②D 为气体单质,写出 B→D 的化学方程式_____;
③E 可用于洗涤剂的生产,则 G 的化学式_____;F→E 的化学方程式_____。
【答案】H2 Fe2O3 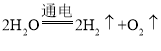 CO CO2+2NaOH=Na2CO3+H2O
CO CO2+2NaOH=Na2CO3+H2O
【解析】
根据A是密度最小的气体可先推出A是氢气,氢气燃烧生成水,水通电生成氢气,可推出B为水,水通电生成氢气和氧气, D为气体单质,A是氢气则D为氧气,A(氢气)、 C 中含有同一种元素可知C含有氢元素,C→B(水) 时溶液呈黄色,溶液呈黄色说明溶液中有铁离子结合C含有氢元素,可推出C为酸,氧化铁与 C (酸)反应生成铁的盐溶液(黄色)和B(水),故与 C(酸) 反应 生成 B(水) 的物质是氧化铁,E 可用于洗涤剂的生产,可知E为碳酸钠,C(酸)和E(碳酸钠)都可以转化成F并且F还可以转化为E(碳酸钠)可推出F为二氧化碳,G和D(氧气)可以反应,并且可以和F(二氧化碳)相互转化,故G为一氧化碳,将各物质代入转化关系图,符合题意,故正确答案为:
(1)H2;Fe2O3;
(2)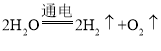
(3)CO;CO2+2NaOH=Na2CO3+H2O

 课课练江苏系列答案
课课练江苏系列答案 名牌中学课时作业系列答案
名牌中学课时作业系列答案【题目】下表是 NaCl 和 KNO3 物质在不同温度下的部分溶解度数据(单位:g/100g水),请回答问题:
温度(℃) | 10 | 20 | 30 | 40 | 50 |
NaCl | 25.8 | 36.0 | 36.3 | 36.6 | 37.3 |
KNO3 | 20.9 | 31.6 | 45.8 | 63.9 | 110 |
①20℃时,NaCl 的溶解度是_____g。
②以上两种物质溶解度变化受温度影响较小的是_____(选填“NaCl”或“KNO3”)。
③20℃时,将 40g KNO3 固体加入 50g 水中,充分搅拌,形成的溶液质量为_____g;加入50g 水后,升温至 40℃,则溶液的溶质质量分数将_____(“不变”“变大”“变小”)。
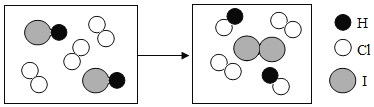
④如图试管中盛放的是 40℃时的硝酸钾饱和溶液,将某物质放入烧杯内的水中,不断搅拌, 试管中有晶体析出,加入的物质是_____(填序号)。
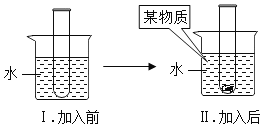
A 硝酸铵 B 干冰 C 生石灰 D 浓硫酸
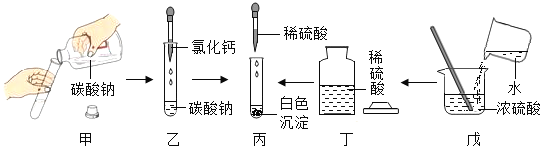
【题目】为探究盐酸的化学性质,某化学小组做了如下实验:
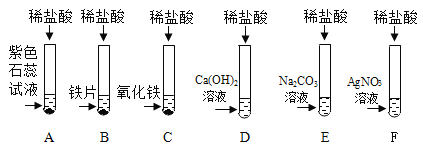
(1)上述反应中无现象的为_______(填字母序号,下同),有白色沉淀出现的是_______;B试管中所发生反应的化学方程式为_______________________________。
(2)将反应后D和E试管中的废液倒入一个洁净的烧杯中,观察到烧杯中先有气泡产生,后有白色沉淀出现。将烧杯中的混合物过滤,得到白色沉淀和无色滤液。同学们对滤液中溶质的成分进行
探究。
(提出问题)滤液中溶质的成分是什么?
(假设与猜想)猜想一:NaCl 猜想二:NaCl和CaCl2
猜想三:NaCl、Ca(OH)2和HCl 猜想四:_____
(讨论与交流)经讨论,同学们一致认为猜想________是错误的。
(实验与结论)
实验步骤 | 实验现象 | 实验结论 |
取少量滤液于试管中,滴加适量碳酸钠溶液 | 无现象 | 猜想四成立 |
取少量滤液于试管中,滴加适量____ | _______ |
(拓展与迁移)稀盐酸和稀硫酸有相似的化学性质,是因为它们的溶液中都存在__________。
【题目】1775年法国化学家拉瓦锡用定量的方法研究了空气的成分。仿照这个历史上著名实验的原理,如今我们的化学教育家积极探索、不断创新,先后设计出了如图所示的实验装置。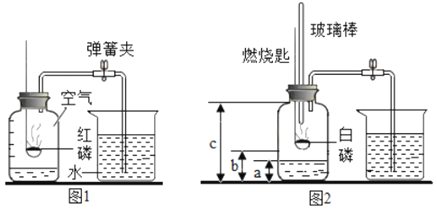
(提出问题)用红磷燃烧的方法为什么测出的氧气含量远低于21%?
(分析讨论)(1)实验装置漏气;(2)______,导致装置内氧气有剩余;(3)……
(实验改进)(1)如图2所示的实验装置进行实验探究。实验前在集气瓶里先装进a体积的水,其作用:一是为了加快集气瓶的冷却速度;二是______。
(2)如图3所示的实验装置进行实验探究。
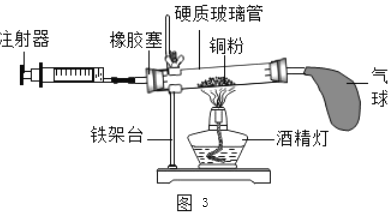
①在实验过程中,不断推拉注射器的目的是______。
②写出该实验中反应的化学方程式______。
③测得实验结果如下(气体体积):(单位:mL)
反应前玻璃管内 | 反应前注射器内 | 反应后注射器内 |
40 | 30 | 18 |
由此数据可以推算出他测定的空气中氧气的体积分数为______。
(实验结论)(1)研究空气的成分实验是在密封容器内进行。
(2)该物质在空气中可以燃烧且只与空气中的氧气反应。
(3)燃烧后的产物______。