题目内容
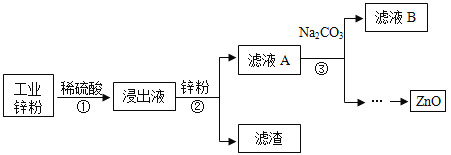
【题目】我国每年报废的手机超过 1 亿部。废旧手机的电路板中含有铝、铁、铜、银、金等多种金属,随意丢弃既会造成资源浪费,也会污染土壤和水体。化学兴趣小组为回收其中的铜,设计并进行了如下实验。已知:Cu+H2O2+H2SO4=CuSO4+2H2O;不考虑金、银发生类似反应。
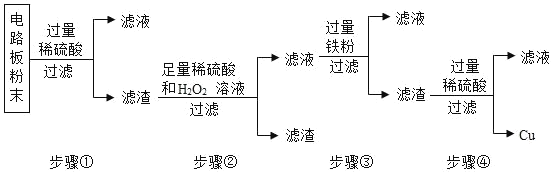
(1)将电路板粉碎成粉末的目的是_____。
(2)步骤①所得滤液中的溶质除硫酸外,还有_____(填化学式)。
(3)步骤②中的实验现象是:_____。
(4)步骤④中反应的化学方程式是_____。
【答案】增大接触面积,使反应更充分,加快反应速率(答案合理即可) FeSO4、Al2(SO4)3 固体部分溶解,溶液由无色变为蓝色 Fe+H2SO4=FeSO4+H2↑
【解析】
(1)将电路板粉碎,可以增大反应物之间的接触面积,从而使反应更充分,加快反应速率。故答案为:增大接触面积,使反应更充分,加快反应速率(答案合理即可);
(2)加入过量稀硫酸,铝能和稀硫酸反应生成硫酸铝、铁能和稀硫酸反应生成硫酸亚铁,铜银、金和硫酸不反应,所以滤液中除硫酸外,还含有硫酸亚铁和硫酸铝。故答案为:FeSO4、Al2(SO4)3;
(3)步骤①所得的滤渣是铜、银、金,加入足量稀硫酸和过氧化氢溶液,铜能和稀硫酸、过氧化氢反应生成硫酸铜和水,会观察到固体部分溶解,溶液由无色变为蓝色。故答案为:固体部分溶解,溶液由无色变为蓝色;
(4)步骤②所得的滤液中一定含有硫酸铜,加入过量铁粉,铁粉和硫酸铜溶液反应生成硫酸亚铁和铜,所以步骤③所得的滤渣中含有铜和铁。步骤④中加入过量稀硫酸,稀硫酸会和铁发生反应生成硫酸亚铁和氢气。故答案为:Fe+H2SO4=FeSO4+H2↑。

 黄冈冠军课课练系列答案
黄冈冠军课课练系列答案【题目】某化学兴趣小组用实验室常用药品(或溶液)对 “NaOH 溶液与稀盐酸是否恰好完全反应”进行探究。
(知识卡片):氯化钠溶液显中性。氯化铜易溶于水。
(实验探究):
(1)方案I:某同学先向试管中加入约 2mL NaOH 溶液,再滴入几滴酚酞溶液,溶液变红。然后慢慢滴入稀盐酸,边滴边振荡,直至溶液恰好变为无色。
①实验结论_____。
②从微观的角度分析,该反应的实质是_____。
(2)方案Ⅱ:
实验步骤 | 实验现象 | 结论 |
取 2mL NaOH 溶液于试管中,滴入一定量的稀盐酸,振荡后加入镁条 | 若_____ | 稀盐酸过量 |
若没有明显现象 | NaOH 溶液与稀盐酸恰好完全反应 |
(实验反思):
(3)另有同学提出方案Ⅱ不能证明 NaOH 溶液与稀盐酸恰好完全反应,其原因是_____。
(4)除以上方案外,下列哪些物质单独使用,也能证明 “NaOH 溶液与稀盐酸是否恰好完全反应”_____(填序号)。
A铜片 BpH 试纸 C氧化铜 D紫色石蕊试液
【题目】氢氧化钡与氢氧化钙同属于碱类物质,其化学性质相似吗?某兴趣小组的同学对此进行探究。
Ⅰ.定性探究
序号 | 操作 | 现象 | 结论 |
实验一 | 向氢氧化钡溶液中滴入_____试剂 | 溶液变红 | 氢氧化钡溶液呈碱性 |
实验二 | 向实验一的溶液中通入适量的二氧化碳 | 产生_____, 红色消失 | 氢氧化钡溶液能与 二氧化碳反应 |
实验三 | 另取氢氧化钡溶液,滴入一定量 的碳酸钠溶液 | 产生白色沉淀 | 氢氧化钡溶液能与 碳酸钠溶液反应 |
(1)写出实验三中发生反应的化学方程式________________________;
同学们将上述三个实验中反应后的废液都倒入一个烧杯中,过滤后,得到白色沉淀和红色滤液,他们决定对沉淀和滤液进行探究。
探究一:(提出问题)沉淀能否与酸发生反应?
(实验探究)向沉淀中加入足量的稀硫酸,观察到有气泡产生,最终沉淀______________(填“消失”或“不消失”)。
探究二:(提出问题)滤液中除指示剂外,还有哪些溶质?
(作出猜想)①氢氧化钠, ②氢氧化钠、碳酸钠, ③__________________。
(实验探究)
序号 | 操作 | 现象 | 结论 |
实验四 | 取滤液样品于试管中, 加入几滴稀盐酸 | 没有明显现象 | 猜想②不成立 |
实验五 | 取滤液样品于试管中, 加入几滴碳酸钠溶液 | 产生沉淀 | 猜想_____成立 |
(2)有同学提出:实验四的操作存在问题,导致结论不准确,请你改正:___________________________________________________。
(3)小组同学讨论后发现,只用一种溶液做一次实验,就可以验证猜想,该溶液是_____。
Ⅱ.定量探究
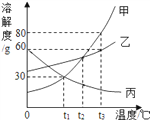
向100g氢氧化钡溶液中滴加溶质质量分数为10%的硫酸铜溶液,溶液的导电能力随着硫酸铜溶液的加入发生如图的变化关系。

溶液处于B点时,其中含有的是_____、_____、_____(填微粒符号)。