题目内容
【题目】(8分)甲同学误把H2O2溶液当作酸与Fe2O3粉末混合,发现有大量气泡产生。他联想到MnO2可作为H2O2分解的催化剂,那么,Fe2O3能否作为H2O2分解的催化剂呢?请你一起参与探究,并填写下列空白。
【猜想】Fe2O3能作为H2O2分解的催化剂。
【实验验证】甲同学依次设计了三个实验:
实验一 取一定量的H2O2溶液于试管中,观察到有极少量气泡产生,伸入带火星的木条,没有复燃。说明H2O2溶液常温下缓慢分解。
实验二 在实验一的试管中加入W g Fe2O3粉末,有大量气泡产生,然后伸入带火星的木条,木条复燃。说明 ;
实验三 待反应结束后,将试管里的不溶物滤出,并洗涤、干燥、称量,固体质量仍为W g。说明 ;
【实验结论】甲同学认为,Fe2O3粉末可以作为H2O2分解的催化剂。
【反思评价】乙同学认为要证明甲同学的结论正确,仅做这三个实验还不充分,需要再补充一个探究实验。探究 。
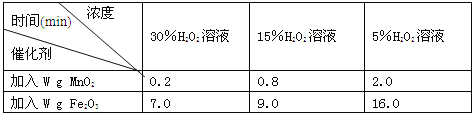
【拓展】下表是丙同学探究影响H2O2分解因素时所记录的部分数据,通过对数据分析,你能得出什么结论? 。
用足量等体积H2O2溶液制取相同体积O2所需的时间:
【答案】能加快反应速率,迅速产生氧气;反应前后固体质量不变;氧化铁的化学性质是否改变;氧化铁的催化效率不如二氧化锰
【解析】
试题分析:实验二说明氧化铁能加快过氧化氢的反应速率;判断一种物质是否是反应中的催化剂,那么要看它是否具有催化剂的特征,即:能改变物质的反应速率,但自身的质量和化学性质不变。由于该实验仅仅测定出了氧化铁能加快过氧化氢的分解速率和氧化铁在反应前后的质量不变,故还要实验判断出氧化铁的化学性质在化学反应前后是否改变;
由表格信息可知,同种催化剂的条件下,反应物的浓度越大,反应速率越快;反应物的浓度相等时,氧化铁的催化效率不如二氧化锰。