题目内容
【题目】重庆一中化学兴趣小组的同学将氢氧化钠溶液和稀硫酸混合,没有观察到明显的现象,他们对此提出了如下问题并进行了相应探究:
问题一:二者之间是否发生了反应?他们设计了如下方案证明二者之间确实发生了反应:
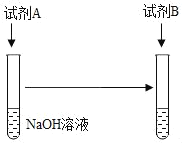
(1)可以选择的试剂组合有_____(填序号)。
①试剂 A:足量稀硫酸,试剂 B:MgCl2溶液
②试剂 A:足量稀硫酸,试剂 B:铁粉
③试剂 A:少量稀硫酸,试剂 B:MgCl2溶液
④试剂 A:少量稀硫酸,试剂 B:铁粉
(2)小兰认为,若选用_____溶液,不管加入顺序如何,只需控制加入稀硫酸的量也 能证明二者发生了反应。
问题二:反应后溶液中溶质有哪些?
(猜想假设)猜想一:只有 Na2SO4;猜想二:Na2SO4 和_____;猜想三:Na2SO4 和 H2SO4。
(查阅资料)①Na2SO4 溶液显中性,②Na2SO4+BaCl2=BaSO4↓+2NaCl。
(实验操作)分别取少量反应后的溶液于试管中,进行如下实验:
实验编号 | 实验过程 | 实验现象 |
① | 加入酚酞溶液 | 不变红 |
② | 加入少量 BaCl2溶液 | 产生白色沉淀 |
③ | 加入少量 Na2CO3溶液 | _____(填“有”或“无”)气泡产生 |
(实验结论)猜想一成立。
(实验反思)小娜认为,实验_____(填实验编号)可省略。 小秋用精密仪器检测反应后溶液中离子的个数比,也得出了相同结论,则测得溶液中的 Na+和 SO42﹣个数比为_____。
【答案】A 酚酞 NaOH 无 ② 2:1
【解析】
问题一:(1)①氢氧化钠能和氯化镁反应生成氢氧化镁沉淀,加入足量稀硫酸后,再加入试剂MgCl2 溶液,没有白色沉淀生成,说明溶液中已没有氢氧化钠,证明氢氧化钠被硫酸反应掉,选项正确;
②加入足量稀硫酸,后硫酸有剩余,加入试剂铁粉,铁和硫酸反应生成硫酸亚铁和氢气,不能证明氢氧化钠和硫酸反应,选项错误;
③加入少量稀硫酸时氢氧化钠有剩余,再加入MgCl2 溶液生成白色沉淀,不能证明氢氧化钠和硫酸反应,选项错误;
④加入少量稀硫酸,氢氧化钠有剩余,铁粉和氢氧化钠不反应,无明显现象,不能证明氢氧化钠和硫酸反应,选项错误;故选A;
(2)氢氧化钠溶液显碱性,能使酚酞试液变红,若选用酚酞试液,不管加入顺序如何,只需控制加入稀硫酸的量,酚酞试液不变色,也能证明二者发生了反应;
问题二:反应后溶液中溶质一定有生成的硫酸钠,可能有剩余的硫酸或氢氧化钠,
猜想假设:
猜想一:只有 Na2SO4;猜想二:Na2SO4 和NaOH;猜想三:Na2SO4 和 H2SO4。
①加入酚酞溶液,不变红,说明溶液中没有氢氧化钠;
②加入少量 BaCl2 溶液,产生白色沉淀,因为硫酸钠和硫酸都能与氯化钡反应生成硫酸钡沉淀,因此本实验不能证明是否有硫酸;
③加入少量 Na2CO3 溶液没有气泡产生,说明没有硫酸;故猜想一成立;
实验反思:
由于反应后生成物一定存在,实验②可省略。用精密仪器检测反应后溶液中离子的个数比,也得出了相同结论,则测得溶液中的 Na+和 SO42-个数比为2:1,因硫酸过量时,硫酸钠和硫酸中都有硫酸根,Na+和 SO42-个数比小于2:1。