题目内容
【题目】将质量相等的A、B、C三种金属,同时分别放入三份质量分数相同且足量的的稀盐酸中,反应生成的H2质量与时间关系如图,得出结论正确的是(已知A、B、C在生成物中均为+2价)
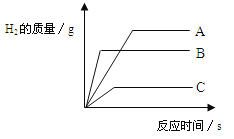
A.金属的活动性顺序A﹥B﹥C
B.生成H2的质量C﹥B﹥A
C.相对原子质量C﹥B﹥A
D.反应速率最大的是A
【答案】C
【解析】
试题分析:A.由图像可知三种金属的活动性顺序B﹥A﹥C ,错误;B、由图像知,三种金属完全反应时,生成氢气的质量关系为:A﹥B﹥C,错误;C、依据金属与酸反应产生氢气的计算公式:氢气质量=金属质量*(金属元素在盐中的化合价绝对值/金属的相对原子质量),假设金属的质量均为a克,根据产生氢气质量多少,可比较三种金属相对原子质量大小,即C﹥B﹥A,正确;D、产生氢气的速率与金属活动性顺序有关,金属越活泼,产生氢气越快,则反应速率最大的是B

练习册系列答案
相关题目