题目内容
【题目】(5分)直接用煤作家用燃料既污染空气又浪费能源。煤的气化是把煤变为清洁能源的重要一环,其中的一个反应是:C+H2O(g)![]() CO+H2,该反应中表现出还原性的物质是 。
CO+H2,该反应中表现出还原性的物质是 。
(1)某能源物质燃烧的微观过程如下:![]()
若“![]() ”表示碳原子,“
”表示碳原子,“![]() ”表示氢原子,“
”表示氢原子,“![]() ”表示氧原子,该反应的生成物A应为 (填字母序号)。
”表示氧原子,该反应的生成物A应为 (填字母序号)。
A.CO B.CO2 C.CO2和CO
(2)酒精灯是实验室的常用热源,请写出酒精(C2H5OH)燃烧的化学方式程: 。
(3)3.2g某物质完全燃烧产生4.4gCO2和3.6gH2O,没生成别的物质。该物质中C、H元素质量比为 。该物质中 (填“含”或“不含”)氧元素。
【答案】C (1) B (2)C2H5OH+3O2![]() 2 CO2+3H2O (3)3:1 含
2 CO2+3H2O (3)3:1 含
【解析】
试题分析:在化学反应中能够夺取氧元素,具有还原性,故结合反应:C+H2O(g)![]() CO+H2,该反应中表现出还原性的物质C
CO+H2,该反应中表现出还原性的物质C
(1)根据质量守恒定律的微观解释:在化学反应前后,原子的种类、个数都不变,,根据化学反应的微观示意图,可判断反应的生成物A应为CO2,应选B
(2)酒精(C2H5OH)燃烧的化学方程式:C2H5OH+3O2![]() 2 CO2+3H2O
2 CO2+3H2O
(3)根据质量守恒定律:化学反应前后,元素的种类、质量都不变,故4.4gCO2中所含的碳元素质量即为物质中所含的碳元素质量=4.4g×12/44×100%=1.2g,3.6gH2O中所含的氢元素质量即为物质中所含的氢元素质量=3.6g×2/18×100%=0.4g ,该物质中C、H元素质量比=1.2g:0.4g=3:1 ,由于碳元素质量1.2g+氢元素质量0.4g=1.6g<3.2g,故该物质中含氧元素

【题目】(10分)小华同学为了测定石灰石样品中碳酸钙的质量分数,取相等质量(14.0g)的五份样品分别和稀盐酸反应,其实验数据记录如下表。(杂质既不溶于水也不跟酸反应;不考虑二氧化碳在水中的溶解)通过对数据的分析和比较,回答下列有关问题:
盐酸的质量(g) | 10 | 20 | 40 | 60 | 80 |
二氧化碳质量(g) | 0.88 | 1.76 | 3.52 | 4.4 | X |
(1)X的数值为 。
(2)7.4g氢氧化钙与 g碳酸钙含的钙元素质量相等?
(3)请在下图中画出在14.0g样品中加稀盐酸的质量与产生气体质量变化的函数关系示意图。
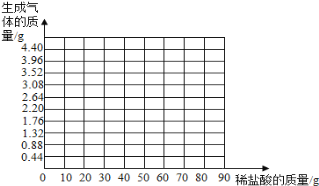
(4)石灰石样品中碳酸钙的质量分数是?(精确到0.1%)