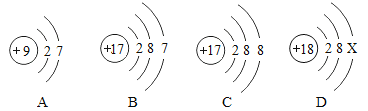
题目内容
【题目】(1)自然界中吸收大气中CO2的最重要环节是_____.
(2)科学家研究得到:海洋是吸收大量CO2的地方.如果CO2排放量继续增加,海洋将被“酸化”.请写出海洋酸化原因的化学方程式________.
(3)科学家目前正在研究将空气中过量的CO2和H2在催化剂和适量条件下转化成液态甲醇和水,反应的化学方程式:CO2+3H2 甲醇+H2O.则甲醇的化学式是______.
甲醇+H2O.则甲醇的化学式是______.
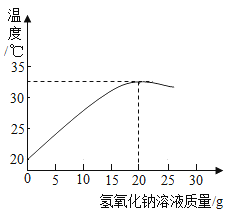
(4)已知20℃时,KCl的溶解度为34克,50℃时的溶解度为42.6克.通过以下实验操作得到溶液①至⑤:
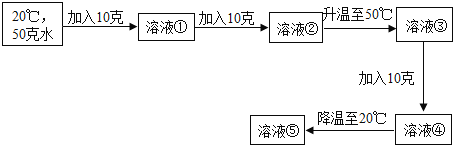
Ⅰ、上述实验所得溶液中,属于饱和溶液的是____;
Ⅱ、溶液④的质量为____克;
Ⅲ、溶液⑤中,溶质的质量分数为_____.
【答案】光合作用 CO2+H2O=H2CO3 CH4O或CH3OH ②④⑤ 71.3 25.4%
【解析】
(1)绿色植物的光合作用可以吸收二氧化碳,释放氧气;自然界中吸收大气中CO2的最重要环节是光合作用。故填:光合作用;
(2)二氧化碳和水反应生成碳酸,碳酸显酸性,化学反应方程式:CO2+H2O=H2CO3;故填:CO2+H2O=H2CO3;
(3)根据化学反应前后原子的种类和数目不变,由CO2+3H2 甲醇+H2O可知,反应前C、H、O原子个数分别为:1、6、2;反应后C、H、O原子个数分别为:0、2、1;故甲醇的化学式是CH3OH。故填:CH4O或CH3OH;
甲醇+H2O可知,反应前C、H、O原子个数分别为:1、6、2;反应后C、H、O原子个数分别为:0、2、1;故甲醇的化学式是CH3OH。故填:CH4O或CH3OH;
(4)由于氯化钾在20℃时的溶解度是34g,即100g水中最多溶解34g氯化钾,50g水中最多溶解17g氯化钾;因此在20℃时在50g水中加入10g氯化钾,氯化钾会全部溶解,得到的①溶液是20℃不饱和溶液;又加入10g氯化钾,由于在50g水中最多溶解17g氯化钾,因此这20g氯化钾只能再溶解17g,所以形成的②溶液是20℃饱和溶液;升温至50℃,由于氯化钾在50℃时的溶解度是42.6g,50g水中最多溶解21.3g氯化钾,因此后加入的氯化钾会全部溶解,而且形成的溶液③是50℃不饱和溶液,但又加入10g氯化钾,这10g氯化钾会再溶解1.3g,形成的溶液④是50℃饱和溶液,然后降温到20℃时,有晶体析出,形成溶液⑤是20℃饱和溶液.
Ⅰ、上述实验所得溶液中,属于饱和溶液的是②④⑤;
Ⅱ、溶液④的质量=50g+21.3g=71.3g;
Ⅲ、⑤是20℃饱和溶液,氯化钾在20℃时的溶解度是34g,即100g水中最多溶解34g氯化钾,溶质的质量分数为![]() ×100%≈25.4%。
×100%≈25.4%。
故填:②④⑤;71.3;25.4%。

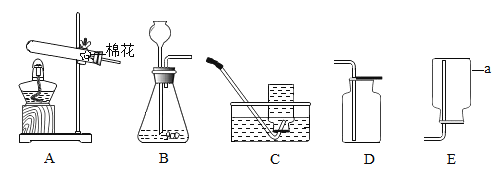
【题目】(6分)硝酸铜为蓝色固体,溶于水可得蓝色溶液。某实验小组同学用下图装置加热硝酸铜,发现固体由蓝色逐渐变黑,同时产生红棕色有刺激性气味的气体,带火星的木条复燃。
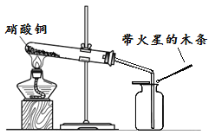
【提出问题】硝酸铜在加热条件下到底发生了怎样的反应?
【查阅资料】
①氧化铜和稀硫酸反应的化学方程式:CuO+H2SO4![]() CuSO4+H2O
CuSO4+H2O
②含氮化合物中,只有NO2是红棕色、有刺激性气味的气体。
③NO2有助燃性,能使带火星的木条复燃
【猜想假设】
Cu(NO3)2受热分解除了生成_______,还可能生成了CuO和O2。
【进行实验】
实验操作 | 实验现象 | 实验结论 |
步骤I:将反应后试管中的固体加水充分溶解, ① ,加热 | 固体全部溶解,得到蓝色溶液 | 硝酸铜分解生成了氧化铜。 |
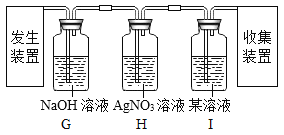
步骤II:在图1的试管和集气瓶之间连上如图所示的装置,重新进行加热硝酸铜的实验
| 集气瓶中气体为无色,带火星木条复燃 | 硝酸铜分解生成了氧气 |
步骤II是同学们查阅了新的资料后设计完成的。该资料是关于NO2___②__方面的性质信息。
【获得结论】根据实验结果,Cu(NO3)2受热分解的化学方程式为_______。
【反思与评价】已知相同状况下,气体的体积比等于其分子个数比。据此,同学们认为,即使没有资料③,依据实验结论和“加热硝酸铜产生的气体能使带火星的木条复燃”的实验现象,也能推出NO2可能具有助燃性。理由是______。