题目内容
【题目】(12分)水是人类生活中不可缺少的物质。
(1)下列净水方法中,通常用于除去水中难溶性杂质的是_____,净水程度最高的是_____
A.过滤 B.煮沸 C.蒸馏 D.吸附
(2)自来水厂常用二氧化氯(ClO2)消毒,其中氯元素的化合价为________;
(3)自来水中含有少量Ca(HCO3)2等可溶性化合物,烧水时Ca(HCO3)2发生分解反应,生成难溶性的碳酸钙、水和二氧化碳,这就是壶中出现水垢的原因之一。请写出Ca(HCO3)2受热分解的化学方程式_______________________。
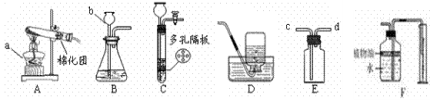
(4)为了探究水的组成,实验装置如图所示

①该实验中,与两个电极相连的a、b两支玻璃管中产生的气体分别是 和 ,质量比为 。②写出该反应的化学方程式
(5)硬水给生活和生产带来很多麻烦,生活中常用 区分硬水和软水,常用 方法降低水的硬度.
【答案】(1)A,蒸馏 (2)+4; (3)Ca(HCO3)2![]() CaCO3 +H2O +CO2↑;
CaCO3 +H2O +CO2↑;
(4)氢气,氧气,1:8,2H2O![]() 2H2↑ + O2↑ (5)肥皂水 ,煮沸
2H2↑ + O2↑ (5)肥皂水 ,煮沸
【解析】
试题分析:(1)净化水的方法有沉淀、过滤、吸附、蒸馏。沉淀包括静止沉淀和吸附沉淀,吸附沉淀时水中要加明矾,作用是明矾溶于水形成胶状物吸附杂质,使杂质沉降,达到净水的目的;过滤可将固体和液体分离,;过滤只除去了难溶性物质,要用活性炭吸附水的颜色和异味;净水程度最高的是蒸馏,通过蒸馏能得到纯净的水;
(2)根据“在化合物中,正负化合价的代数和为零”的原则,其中O为-2价,设Cl的化合价为x ,
可得: x+×2(-2)=0,X=+4;
(3)根据描述,该反应的反应物是Ca(HCO3)2,生成物是碳酸钙、水和二氧化碳,反应条件是加热,故该反应的化学方程式为:Ca(HCO3)2======CaCO3 +H2O +CO2↑;
(4)电解水实验中与正极产生的是氧气,用带火星的小木条检验,负极产生的是氢气,可用燃烧法检验,正负两极气体的体积比为1:2 ,质量比为8:1 ,该实验能得出水是由氢元素和氧元素组成的结论;
(5)检验是硬水还是软水用肥皂水来检验;降低水的硬度的方法有煮沸和蒸馏,生活中用煮沸的方法。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】(9分)根据金属及其化合物的性质和用途,请回答:
(1)下列厨房用品所使用的主要材料,属于金属材料的是 (填字母序号),主要利用了其物理性质中的 性。

(2)某化学小组用一定量的硝酸银和硝酸铜的混合溶液进行了下图所示实验,并对溶液A和固体B的成分进行了分析和实验探究。
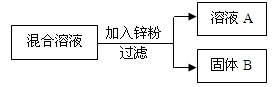
【提出问题】溶液A中的溶质可能有哪些?
【做出猜想】
①只有硝酸锌
②硝酸锌、硝酸银
③硝酸锌、硝酸铜
④硝酸锌、硝酸铜、硝酸银
【交流讨论】不合理的猜想是 (填序号),理由是 。
【实验探究】若猜想①成立,通过以下实验可探究固体B的成分,请填写下表。
实验步骤 | 实验现象 | 化学方程式及结论 |
取少量固体B,滴加 | 有气泡产生 |
固体B的成分是 |
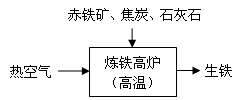
(3)下图是工业炼铁示意图。其中,焦炭的作用是燃烧提供能量和 ,生成铁的化学方程式是 。