题目内容
小亮在实验室发现一瓶盛有无色溶液的试剂瓶,其标签破损,从残余部分只能看出溶质质量分数为10%,具体是什么物质无法辨认。老师告诉他,这瓶溶液可能是氢氧化钠、氯化钠、氢氧化钙或是碳酸钠中的一种。
(1)小亮查阅氢氧化钙常温下的溶解度为0.18g后,认为该溶液不可能是氢氧化钙,理由是 。
(2)小亮用洁净干燥的玻璃棒蘸取该溶液滴到湿润的pH试纸上,测得pH=9,他判断该溶液不可能是氯化钠。对他的操作方法、测量结果及结论的评价,正确的是 ;
A.方法正确,结果正确,且结论正确 B.方法不正确,结果偏小,但结论正确
C.方法不正确,结果偏大,结论不正确 D.方法正确,结果正确,但结论不正确
(3)为了进一步确定该溶液的成分,小亮继续进行下列实验。
[设计实验方案]方案甲:选择氯化钡溶液来确定该溶液的成份;
方案乙:选择稀硫酸来确定该溶液的成份。
[进行实验]在两个方案中选一个方案,填写步骤、现象、结论。
|
实验步骤 |
实验现象 |
实验结论 |
|
取少量溶液于试管,滴加 。 |
|
该溶液是碳酸钠溶液。有关反应的化学方程式为: 。 |
[实验反思]
①有同学认为还可以用一种常见的碱溶液来确定是碳酸钠,该碱溶液可以是 溶液。
有关反应的化学方程式为: 。
②小亮经过反思,向同学们提出如下建议,你认为不合理的是 (填字母)。
A、倾倒液体时应注意保护标签不被腐蚀
B、要有严谨的科学实验的态度
C、无法辨认的药品,直接倒掉,无需保留
(4)用“侯氏制碱法”制得的纯碱中常含有少量的氯化钠。为测定某纯碱样品中碳酸钠的质量分数,小明称取该样品11 g,加入到盛有一定量稀盐酸的烧杯中,恰好完全反应,测得烧杯中物质总质量的变化如图所示。请计算:

①该纯碱样品中碳酸钠的质量分数。(精确到0.1%,下同)
②反应后所得溶液中溶质的质量分数。
(1)<10% (2) B
(3)
|
取少量溶液于试管,滴加 氯化钡溶液(或稀硫酸) 。 |
有白色沉淀 (或有气泡) |
该溶液是碳酸钠溶液。有关反应的化学方程式为:BaCl2+Na2CO3=2NaCl+BaCO3↓。 |
①是 Ca(OH)2 , Ca(OH)2+Na2CO3=2NaOH+CaCO3↓
② C
(4)①96.4% ②21.4%
【解析】
试题分析:(1)根据溶解度与饱和溶液的溶质质量分数的关系,即饱和溶液的溶质质量分数=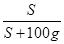 ×100%,结合氢氧化钙常温下的溶解度为0.18g可知,常温下饱和氢氧化钙溶液的溶质质量分数=
×100%,结合氢氧化钙常温下的溶解度为0.18g可知,常温下饱和氢氧化钙溶液的溶质质量分数=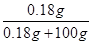 ×100%=0.18%,远小于10%,故该溶液不可能是氢氧化钙。
×100%=0.18%,远小于10%,故该溶液不可能是氢氧化钙。
(2)测定溶液的酸碱度时,不能把pH试纸用水湿润,因为这样相当于把待测溶液稀释,溶液酸碱性会减弱,这样测定出来的碱溶液的pH偏小,但根据测得的pH为9,判断溶液呈碱性还是正确的,故选B。
(3)[进行实验]
根据实验结论“该溶液是碳酸钠溶液”,结合实验方案可知:方案甲滴加氯化钡溶液,能与碳酸钠反应生成白色沉淀(碳酸钡),故反应的化学方程式为BaCl2+Na2CO3=2NaCl+BaCO3↓;方案乙滴加稀硫酸,能与碳酸钠反应生成气泡(二氧化碳),故反应的化学方程式为Na2CO3+H2SO4=Na2SO4+H2O+CO2↑,都能证明溶液为碳酸钠。
[实验反思]
①根据题意,结合已有知识可知,碳酸钠溶液能与Ca(OH)2溶液反应,生成碳酸钙沉淀而使溶液变浑浊,故可利用氢氧化钙溶液检验碳酸钠的存在,二者反应的化学方程式为Na2CO3+ Ca(OH)2=CaCO3↓+2NaOH。
②根据实验室药品使用规则分析。
A、倾倒液体时应注意保护标签不被腐蚀,正确;
B、要有严谨的科学实验的态度,正确;
C、对于标签被腐蚀、无法辨认的药品,要尽可能确定药品的组成,不可随意扔弃,既不安全又造成浪费,错误。故选C
(4)①根据题意,碳酸钠样品中加入稀盐酸,二者反应生成氯化钠、水和二氧化碳,由于二氧化碳气体的逸出,故反应后烧杯内物质的总质量会变小,且变小的质量为生成二氧化碳的质量,结合图示可知,生成二氧化碳的质量=61g-56.6g=4.4g。
根据题意书写反应的化学方程式,利用生成二氧化碳的质量,以及二氧化碳与碳酸钠的质量比,可求出样品中碳酸钠的质量,进而求出该纯碱样品中碳酸钠的质量分数。
解,设样品中碳酸钠的质量为x,生成的氯化钠是y
Na2CO3+2HCl=2NaCl+H2O+CO2↑
106 117 44
x y 4.4g
106:x=44:4.4g
解得x=10.6g
则样品中碳酸钠的质量分数=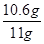 ×100%≈96.4%
×100%≈96.4%
②由于所得溶液中的NaCl的质量为原样品中氯化钠的质量与生成氯化钠的质量之和,故需求出反应生成的氯化钠和原样品中氯化钠的质量。
117:y=44:4.4g
解得,y=11.7g
则氯化钠的质量=11.7g+(11g-10.6g)=12.1g
则所得溶液的溶质质量分数=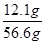 ×100%≈21.4%
×100%≈21.4%
考点:缺失标签的药品成分的探究,溶液的酸碱性与pH值的关系,盐的化学性质,书写化学方程式,根据化学反应方程式的计算,有关溶质质量分数的简单计算
点评:对于验证型实验探究,要熟记物质的性质或变化规律,根据给出的实验设计方案,进行实验、分析和探究,并通过观察、记录和分析的实验现象,来验证该物质的性质或变化规律等。

(1)小亮查阅氢氧化钙常温下的溶解度为0.18g后,认为该溶液不可能是氢氧化钙,理由是
(2)小亮取少量样品于试管中,滴加
(3)为了确定该溶液的成分,小亮同学继续进行下列实验,请一起参与,并填写下列实验报告.
[设计实验方案]方案甲:选择氯化钙溶液来确定该溶液的成份;方案乙:选择稀盐酸来确定该溶液的成份.
[进行实验]你愿意选择方案
| 实验步骤 | 实验现象 | 实验结论 |
| 取少量溶液于试管中, 滴加氯化钙溶液(或稀盐酸) |
产生白色沉淀(或有气泡冒出) | 该溶液是碳酸钠溶液, 有关反应得化学方程式为: CaCl2+Na2CO3═CaCO3↓+2NaCl(或Na2CO3+2HCl═2NaCl+H2O+CO2↑) |
(5)小亮经过反思,向同学们提出如下建议,你认为合理的是
A.倾倒液体时应注意保护标签不被腐蚀 B.要有严谨的科学实验的态度 C.无法辨认的药品,直接倒掉,无需保留.
 (7分)小亮在实验室发现一瓶盛有无色溶液的试剂瓶,其标签破损,从残余部分只能看出溶质质量分数为10%.老师说,这瓶溶液可能是氢氧化钠、氯化钠、氢氧化钙或是碳酸钠中的一种.
(7分)小亮在实验室发现一瓶盛有无色溶液的试剂瓶,其标签破损,从残余部分只能看出溶质质量分数为10%.老师说,这瓶溶液可能是氢氧化钠、氯化钠、氢氧化钙或是碳酸钠中的一种.(1)小亮查阅氢氧化钙常温下的溶解度为0.18g后,认为该溶液不可能是氢氧化钙溶液,理由是
(2)小亮取少量样品于试管中,滴加
(3)为了进一步确定该溶液的成分,小亮设计了以下实验方案:
方案A:选择稀盐酸来确定该溶液的成分;
方案B:选择无色酚酞试液来确定该溶液的成分;
你认为以上方案中合理的是
的化学方程式为
(4)小亮通过上述方法证明该溶液的成分为NaOH,于是他取一定体积的NaOH溶液
(20℃),并向其中滴加10%的盐酸(20℃),测得反应中溶液的温度与加入盐酸体积的变化如下.
| 加入盐酸的体积(V)/mL | 2 | 4 | 6 | 8 | 10 | 12 | 14 | 16 | 18 | 20 |
| 溶液温度 (t)/℃ |
25.2 | 29.6 | 32.0 | 36.0 | 38.2 | 36.7 | 35.7 | 34.7 | 33.7 | 32.9 |
①加入盐酸的量在2~10mL之间时
②加入盐酸的量在10~20mL之间时
(1)小亮查阅氢氧化钙常温下的溶解度为0.18g后,认为该溶液不可能是氢氧化钙,理由是
(2)小亮用洁净干燥的玻璃棒蘸取该溶液滴到湿润的pH试纸上,测得pH=10,他判断该溶液中不可能是氯化钠.对他的操作方法、测量结果及结论的评价,正确的是
A.方法正确,结果正确,且结论正确 B.方法不正确,结果偏小,但结论正确
C.方法不正确,结果偏大,结论不正确 D.方法正确,结果正确,但结论不正确
(3)为了进一步确定该溶液的成分,小亮继续进行下列实验.
[设计实验方案]方案甲:选择氯化钡溶液来确定该溶液的成份;
方案乙:选择稀硫酸来确定该溶液的成份.
[进行实验]在两个方案中选一个方案,填写步骤、现象、结论.
| 实验步骤 | 实验现象 | 实验结论 |
| 取少量溶液于试管,滴加 |
该溶液是碳酸钠溶液. 有关反应的化学方程式为: |
②小亮经过反思,向同学们提出如下建议,你认为不合理的是
A、倾倒液体时应注意保护标签不被腐蚀 B、要有严谨的科学实验的态度
C、无法辨认的药品,直接倒掉,无需保留.
 小亮在实验室发现一瓶盛有无色溶液的试剂瓶,其标签破损,从残余部分只能看出溶质质量分数为10%,具体是什么物质无法辨认.老师告诉他,这瓶溶液可能是氢氧化钠、氯化钠、氢氧化钙或是碳酸钠中的一种.
小亮在实验室发现一瓶盛有无色溶液的试剂瓶,其标签破损,从残余部分只能看出溶质质量分数为10%,具体是什么物质无法辨认.老师告诉他,这瓶溶液可能是氢氧化钠、氯化钠、氢氧化钙或是碳酸钠中的一种.