题目内容
下图所示的实验中,反应前氧化铁和碳粉的质量分别为32克和1.2克,反应后得到气体A和28.8克黑色固体B。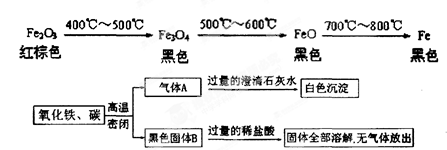
(1)白色沉淀的质量为 g;
(2)推断黑色固体B的化学式。(要求写出推断过程)
(1) 10g (2) FeO
解析试题分析:(1)根据反应过程中的现象,在黑色固体B中加过量的稀盐酸,固体全部溶解,且无气体放出,说明:1、没有碳剩余,2、没有铁生成;根据1,可以这样推断反应前1.2g碳,经过变为二氧化碳,最终变为碳酸钙中的碳,所以可设碳酸钙质量为x
X×12/100×100% = 1.2g
∴x=10
(2)根据上面分析没有铁生成,那么就只有可能两种生成物Fe3O4、FeO
① 假设生成Fe3O4,那方程式为:C+6Fe2O3 4Fe3O4+CO2,可设32克氧化铁要完全反应需要的碳粉质量为x
4Fe3O4+CO2,可设32克氧化铁要完全反应需要的碳粉质量为x
C + 6Fe2O3 4Fe3O4+CO2
4Fe3O4+CO2
12 960
x 32克
12:960 = x:32克
∴ x=0.4克<1.2克 故不是按这个反应进行
②假设生成FeO,那方程式:C+2Fe2O3 4FeO+CO2,可设32克氧化铁要完全反应需要的碳粉质量为y
4FeO+CO2,可设32克氧化铁要完全反应需要的碳粉质量为y
C + 2Fe2O3 4FeO+CO2
4FeO+CO2
12 320
Y 32克
12:320 = y:32克 ∴y=1.2克=1.2克 所以是按这个反应进行,故黑色固体B的化学式FeO
考点:根据化学方程式进行的计算

练习册系列答案
 课课优能力培优100分系列答案
课课优能力培优100分系列答案 优百分课时互动系列答案
优百分课时互动系列答案
相关题目
我国早在春秋战国时期,就开始生产和使用铁器。某化学小组到钢铁厂做社会调查,将不同质量的生铁样品(假定其中只含铁和碳两种单质)分别放入5只烧杯中,各加入189.2 g质量分数相同的稀硫酸进行实验,实验数据见下表:
| | 烧杯① | 烧杯② | 烧杯③ | 烧杯④ | 烧杯⑤ |
| 加入生铁样品 的质量/g | 3.0 | 6.0 | 9.0 | 12.4 | 14.0 |
| 充分反应后 生成气体 的质量/g | 0.1 | M | 0.3 | 0.4 | 0.4 |
试计算:
(1)表中M的值为________。
(2)烧杯④中完全反应后,所得溶液中溶质的质量是多少?(写出计算过程)