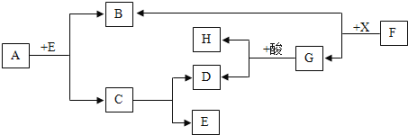
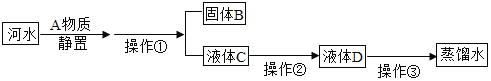
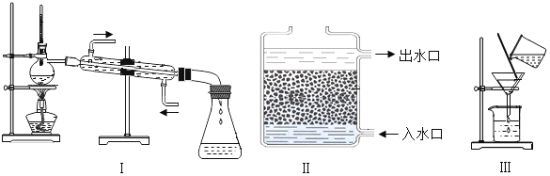
题目内容
【题目】有等质量的镁和锌,前者放入质量分数为10%的稀盐酸中,后者放入质量分数为10%的稀硫酸中,产生氢气的质量随时间变化曲线如图所示.下列说法正确的是( )

A.锌一定没有剩余
B.最终产生氢气的质量相等
C.消耗镁的质量与消耗锌的质量之比为1:1
D.消耗的稀盐酸和稀硫酸质量之比为73:98
【答案】B、D
【解析】
试题根据右图可以看出,两者最终产生的氢气质量相等,所以B正确,再根据镁与稀盐酸反应的化学方程式:2HCl+ Mg=MgCl2+ H2↑,HCl的质量与氢气的质量关系73:2,锌与稀硫酸反应的化学方程式:H2SO4 +Zn=ZnSO4 + H2↑,H2SO4的质量与氢气的质量关系是98:2,因为两者最终产生的氢气质量相等,所以不难算出消耗的HCl和H2SO4质量之比为73:98,而两者的质量分数都为10%,故消耗的稀盐酸和稀硫酸质量之比为73:98,所以D也正确,而根据镁的质量与氢气的质量关系24:2,锌的质量与氢气的质量关系65:2,要产生相同质量的氢气,消耗镁的质量与消耗锌的质量之比为24:65,所以C错误,由于最初的金属质量相等,而两种酸的质量也不知道,到底在反应中哪种物质过量,哪种物质又反应完有不确定性,所以A错误,故选B、D

 阅读快车系列答案
阅读快车系列答案【题目】一定条件下,甲、乙、丙、丁四种物质在一密闭容器中充分反应,测得反应前后各物质的质量如下表:
物质 | 甲 | 乙 | 丙 | 丁 |
反应前质量/g | 2 | 8 | 30 | 50 |
反应后质量/g | 36 | 8 | 待测 | 22 |
(1)经计算待测数值为____________。
(2)该反应基本类型为 ___________。
(3)该实验中乙为该反应的催化剂,则在化学反应前后乙的______和 ________不发生改变。
(4)已知丙和丁的化学计量数之比是3:1,则丙和丁的相对分子质量之比为___________(填序号)。
A .1﹕14 B.3﹕14 C.12﹕11 D.3﹕5