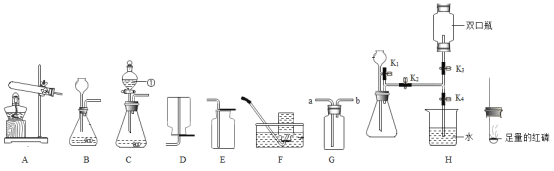
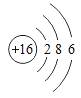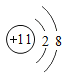题目内容
【题目】下列化学方程式与事实相符且正确的是
A.碳在氧气中完全燃烧2C+O2![]() 2CO
2CO
B.用足量澄清石灰水检验二氧化碳:CO2 + Ca(OH)2 ═ CaCO3↓ + H2O
C.铝在空气中发生反应,其表面生成一层致密的氧化铝薄膜:2Al + 3O2 = Al2O3
D.铁与稀盐酸反应:2Fe + 6HCl = 2FeCl3 + 3H2↑
【答案】B
【解析】
A、碳在氧气中完全燃烧生成二氧化碳,正确的化学方程式应为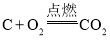 ,故A不正确;
,故A不正确;
B、澄清石灰水检验二氧化碳生成碳酸钙和水,该化学方程式书写完全正确,故B正确;
C、化学方程式配平错误,正确的化学方程式应为![]() ,故C不正确;
,故C不正确;
D、铁和盐酸反应生成氯化亚铁和氢气,正确的化学方程式为Fe+2HCl═FeCl2+H2↑,故D不正确。故选B。

 一线名师权威作业本系列答案
一线名师权威作业本系列答案【题目】研究和控制化学反应条件有重要意义。
(1)同学们想探究双氧水的浓度对反应速率的影响。在其他条件相同的情况下进行了三次实验,记录各收集一瓶相同体积氧气所需要的时间。
实验 | 30%双氧水的质量(g) | 加入的水的体积(mL) | 二氧化锰质量(g) | 收集时间(s) |
1 | 10 | 40 | 5 | 200 |
2 | 20 | 30 | 5 | 100 |
3 | 30 | 20 | 67 |
①写出上述反应的化学符号表达式_____。
②实验3中,加入的二氧化锰质量为_____g。
③相同条件下,实验3产生氧气的速率最快,说明_____。
(2)同学通过查阅资料得知,双氧水在70℃以上会较快分解产生氧气。为了验证加热双氧水也可以产生氧气,同学们进行实验。实验中观察到试管内产生气泡,但将带火星的木条放在导管口没有复燃,可能的原因是_____。
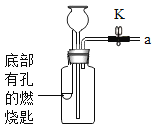
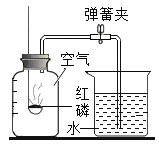
【题目】利用表中装置进行下列实验,已知:白磷的着火点为40℃。
实验装置 | 实验1 | 实验2 |
| Ⅰ.将盛有足量锌粒的燃烧匙伸入瓶中,塞紧瓶塞。 Ⅱ.打开K,从长颈漏斗向瓶内加入稀盐酸,至浸没锌粒。 Ⅲ.当瓶中产生大量气泡时,关闭K。 | Ⅰ.将盛有白磷的燃烧匙伸入 瓶内,塞紧瓶塞。 Ⅱ.打开K,从长颈漏斗向瓶内加入约80℃的热水,至浸没白磷。 Ⅲ.从a口向瓶中鼓入空气,使瓶中液面低于燃烧匙底部,关闭K。 |
(1)连接仪器后,关闭K,加水至长颈漏斗内液面高于瓶中液面,一段时间后,液面高度保持不变,该现象说明______。
(2)实验1中,瓶内发生反应的化学方程式为______,步骤Ⅲ中,关闭K后的现象是______。
(3)实验2中,仅对比步骤Ⅱ和Ⅲ可知,欲探究的燃烧条件是______。白磷燃烧的化学方程式是________________________。
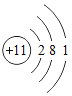
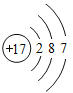
【题目】下图是常见的粒子结构示意图,请根据粒子结构示意图回答下列问题:
粒 子 结 构 示意图 |
|
|
|
|
编 号 | A | B | C | D |
(1)上述微粒示意图中表示阳离子的是_____(填编号)。
(2)由同一种元素B形成的单质是_____(填化学式)。
(3)上述微粒中属于同一种元素的是_____(填编号)。
(4)元素C在化学反应中表现出的最高化合价是_____价,C元素最高价与氧元素形成氧化物的化学式是_____。