题目内容
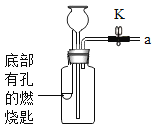
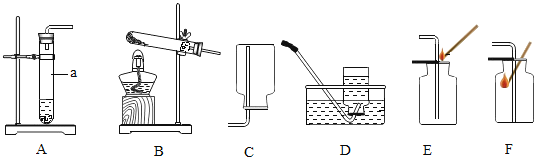
【题目】利用表中装置进行下列实验,已知:白磷的着火点为40℃。
实验装置 | 实验1 | 实验2 |
| Ⅰ.将盛有足量锌粒的燃烧匙伸入瓶中,塞紧瓶塞。 Ⅱ.打开K,从长颈漏斗向瓶内加入稀盐酸,至浸没锌粒。 Ⅲ.当瓶中产生大量气泡时,关闭K。 | Ⅰ.将盛有白磷的燃烧匙伸入 瓶内,塞紧瓶塞。 Ⅱ.打开K,从长颈漏斗向瓶内加入约80℃的热水,至浸没白磷。 Ⅲ.从a口向瓶中鼓入空气,使瓶中液面低于燃烧匙底部,关闭K。 |
(1)连接仪器后,关闭K,加水至长颈漏斗内液面高于瓶中液面,一段时间后,液面高度保持不变,该现象说明______。
(2)实验1中,瓶内发生反应的化学方程式为______,步骤Ⅲ中,关闭K后的现象是______。
(3)实验2中,仅对比步骤Ⅱ和Ⅲ可知,欲探究的燃烧条件是______。白磷燃烧的化学方程式是________________________。
【答案】装置的气密性良好 Zn+2HCl=ZnCl2+H2↑ 瓶内液面逐步缓缓下降,长颈漏斗中的液面上升,反应会因为瓶中液面过低而停止 燃烧需要氧气 4P+5O2![]() 2P2O5
2P2O5
【解析】
锌和盐酸反应产生氯化锌和氢气,磷在氧气中点燃生成五氧化二磷。
(1)连接仪器后,关闭K,加水至长颈漏斗内液面高于瓶中液面,一段时间后,液面高度保持不变,该现象说明装置的气密性好。
(2)锌和盐酸反应产生氯化锌和氢气,反应的方程式为Zn+2HCl=ZnCl2+H2↑;步骤Ⅲ中,当瓶中产生大量气泡时,关闭K,由于瓶内压强变大,瓶内液面逐步缓缓下降,长颈漏斗中的液面上升,反应会因为瓶中液面过低而停止。
(3)步骤Ⅱ打开K,从长颈漏斗向瓶内加入约80℃的热水,至浸没白磷,温度达到着火点,步骤Ⅲ从a口向瓶中鼓入空气,使瓶中液面低于燃烧匙底部,关闭K白磷燃烧,故仅对比步骤Ⅱ和Ⅲ可知,欲探究的燃烧条件是燃烧需要氧气,白磷燃烧生成五氧化二磷,反应的化学方程式是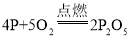 。
。

 ABC考王全优卷系列答案
ABC考王全优卷系列答案