题目内容
【题目】研究和控制化学反应条件有重要意义。
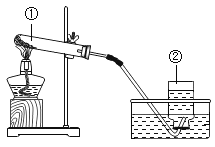
(1)同学们想探究双氧水的浓度对反应速率的影响。在其他条件相同的情况下进行了三次实验,记录各收集一瓶相同体积氧气所需要的时间。
实验 | 30%双氧水的质量(g) | 加入的水的体积(mL) | 二氧化锰质量(g) | 收集时间(s) |
1 | 10 | 40 | 5 | 200 |
2 | 20 | 30 | 5 | 100 |
3 | 30 | 20 | 67 |
①写出上述反应的化学符号表达式_____。
②实验3中,加入的二氧化锰质量为_____g。
③相同条件下,实验3产生氧气的速率最快,说明_____。
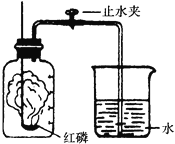
(2)同学通过查阅资料得知,双氧水在70℃以上会较快分解产生氧气。为了验证加热双氧水也可以产生氧气,同学们进行实验。实验中观察到试管内产生气泡,但将带火星的木条放在导管口没有复燃,可能的原因是_____。
【答案】H2O2![]() H2O+O2 5 相同条件下,反应物的浓度越大,反应速率越快 氧气中混有较多的水蒸气
H2O+O2 5 相同条件下,反应物的浓度越大,反应速率越快 氧气中混有较多的水蒸气
【解析】
(1)①过氧化氢在二氧化锰的催化作用下生成水和氧气,反应的方程式是:H2O2![]() H2O+O2;故填:H2O2
H2O+O2;故填:H2O2![]() H2O+O2;
H2O+O2;
②实验探究双氧水的溶质质量分数对反应速率的影响。所以在其他条件相同的情况下进行了三次实验,所以实验3中,加入的二氧化锰质量为5g;故填:5;
③由实验数据可知相同条件下,实验3产生氧气的速率最快,说明其他条件相同时,反应物的浓度越高,反应速率越快;故填:相同条件下,反应物的浓度越大,反应速率越快;
(2)在加热双氧水的过程中一定会有水蒸气散出,使收集的氧气不纯,所以将带火星的木条放在导管口没有复燃;
故答案为:氧气中混有较多的水蒸气。

练习册系列答案
相关题目