题目内容
【题目】结合下列实验装置图回答问题:

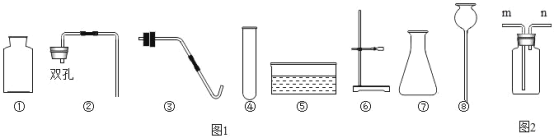
(1)指出编号仪器名称:①_____。
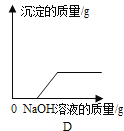
(2)实验室利用D装置制取氧气,反应原理用化学方程式表示为_____。
(3)在实验室里,可用硫化亚铁固体和稀硫酸反应来制取硫化氢气体。在通常情况下硫化氢是一种无色、有臭鸡蛋味的有毒气体,能溶于水且水溶液呈酸性,密度比空气大。实验室制取硫化氢应选用的最佳发生装置是_____(填字母),若选用G装置收集硫化氢,气体应从_____(填“a”或“b”)口进入,实验结束后剩余的硫化氢可以用氢氧化钠溶液来吸收。
(4)正确连接下图所示三套装置进行实验,可以验证某气体是由H2、CO中的一种或两种组成。(注: 无水硫酸铜遇水变蓝色)则正确的连接顺序是:气体→_____→尾气处理(填导管接口代号),证明含有H2的现象是_____,证明含有CO的现象是_____。
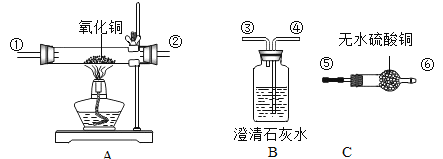
【答案】长颈漏斗 2KMnO4![]() K2MnO4+MnO2+O2↑ B b ①②⑤⑥③④ A中黑色粉末变红色,C中无水硫酸铜变蓝色 澄清石灰水变浑浊
K2MnO4+MnO2+O2↑ B b ①②⑤⑥③④ A中黑色粉末变红色,C中无水硫酸铜变蓝色 澄清石灰水变浑浊
【解析】
(1)据图可知仪器①是长颈漏斗,故答案为:长颈漏斗;
(2)D装置的试管中有棉花团,因此是加热高锰酸钾制氧气,高锰酸钾受热分解生成锰酸钾和二氧化锰和氧气,配平;故答案为:2KMnO4![]() K2MnO4+MnO2+O2↑;
K2MnO4+MnO2+O2↑;
(3)在实验室里,可用硫化亚铁固体和稀硫酸反应来制取硫化氢气体,因此不需要加热;实验室制取硫化氢应选用的最佳发生装置是B,因为分液漏斗可以控制反应的速率;若选用G装置收集硫化氢,气体应从长管进入,因为硫化氢气体的密度比空气大;故答案为:B;b;
(4)氢气和一氧化碳都可以与氧化铜反应,氢气与氧化铜反应后有单质铜和水生成,一氧化碳与氧化铜反应后有二氧化碳和单质铜生成,可以通过产物中是否有水或二氧化碳生成来判定原混合气体中是否含有氢气或二氧化碳,氢氧化钙溶液可以检验二氧化碳,无水硫酸铜可以检验水,由于氢氧化钙溶液中含有水,故为了防止氢氧化钙溶液中带出水影响水的检验,故要先用无水硫酸铜检验是否有水生成,后用澄清石灰水检验是否有二氧化碳生成,故如图2所示三套装置进行实验,可以验证某气体是由H2、CO中的一种或两种组成。(注:无水硫酸铜遇水变蓝色)则正确的连接顺序是:气体→①②⑤⑥③④→尾气处理;证明含有H2的现象是:C中无水硫酸铜变蓝色;证明含有CO的现象是:B中澄清的石灰水变浑浊;故答案为:①②⑤⑥③④;C中无水硫酸铜变蓝色;B中澄清的石灰水变浑浊。

 名校课堂系列答案
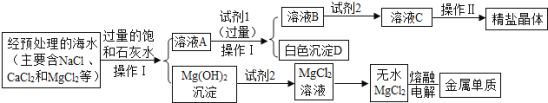
名校课堂系列答案【题目】氢氧化镁是一种重要的化工原料,某矿石由MgO、Fe2O3、CuO和SiO2组成。用它制备氢氧化镁的流程示意图如下:

部分金属阳离子以氢氧化物形成沉淀时溶液的pH见下表:
沉淀物 | Fe(OH)3 | Cu(OH)2 | Mg(OH)2 |
开始沉淀 | 1.9 | 4.2 | 9.1 |
完全沉淀 | 3.2 | 6.7 | 11.1 |
(1)熟石灰主要成分的化学式是____________。
(2)溶液A中的阳离子是___________________(填离子符号)。
(3)沉淀C的成分是_____________________。
(4)溶液B与熟石灰反应的化学方程式是____________________________________。
【题目】黄铜是一种重要的金属,它是铜和锌的合金,可用来制造机器、电器零件及日常用品。为了测定黄铜样品的组成,取五份样品分别加稀硫酸反应,其实验数据记录如下:
样品 | 第1份 | 第2份 | 第3份 | 第4份 | 第5份 |
取样品质量(g) | 40.0 | 40.0 | 40.0 | 40.0 | 40.0 |
取稀硫酸质量(g) | 30.0 | 60.0 | 90.0 | 120.0 | 150.0 |
产生气体质量(g) | 0.3 | 0.6 | 0.9 | 1.0 | 1.0 |
按要求回答下列问题:
(1)根据实验数据分析,从第___份开始,金属已经反应完全了。
(2)列式计算该黄铜样品中金属锌的质量分数___。(要求写出计算过程)
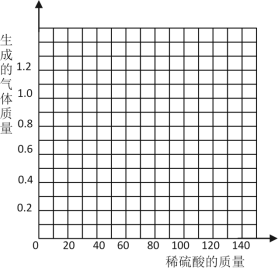
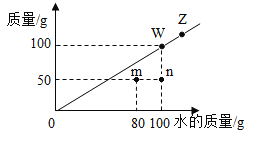
(3)在给出的坐标纸上,画出40.0g样品中加稀硫酸的质量与产生气体质量的关系曲线___。