��Ŀ����
����Ŀ��2013��6��3�գ�����ʡ�»���ij��˾������������Һ��й©��������ѧ��ը������ش�������Һ����Һ̬�İ����������£�������NH3����һ����ɫ���д̼�����ζ�����壬�ܶȱȿ���С��ʵ���ҳ����Ȼ�粒������ʯ�ҹ��干����ȡ��������ش��������⣺ 
��1��Һ��й©ʱ��������ˮ�ķ�����ȥ�����еİ�����˵�������������������ʣ���Һ��������ѧ��ը�²ⰱ�����ܾ����Ļ�ѧ���ʣ�
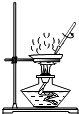
��2��д����ͼ��ָ�����������ƣ�a ��
��3����ȡ�����ķ���װ��Ӧѡ��ͼ�е�������ĸ����ͬ�����ռ�װ��Ӧѡ����� �� ���ַ���װ��Ҳ������ʵ�������������ø�װ������������ҩƷ�� ��
��4�����ݰ����������Ʋ⣬����Һ��й©ʱ��ȷ�����������������о���������
���𰸡�
��1������ˮ����ȼ��
��2����Һ©��
��3��A��C��������أ����������������̵Ļ���
��4����ʪë����ס�ڱǣ�����������������
���������⣺��1��Һ��й©ʱ��������ˮ�ķ�����ȥ�����еİ�����˵��������������ˮ���������ʣ������°���һ�ֿ�ȼ���壬�����ѵ�ȼ����ը����Ϊ16%��25%��������ȼŨ��Ϊ17%�� �ʴ�Ϊ������ˮ����ȼ�ԣ���2����Һ©�����Կ��Ʒ�Ӧ���ٶȣ�
�ʴ�Ϊ����Һ©������3��ʵ���ҳ����Ȼ�粒������ʯ�ҹ��干����ȡ�����������Ҫ���ȣ������£�������NH3����һ����ɫ���д̼�����ζ�����壬�ܶȱȿ���С��������ˮ�����ֻ���������ſ������ռ�������ø�����ػ����������������Ҫ���ȣ�
�ʴ�Ϊ��A��C��������أ����������������̵Ļ�������4������Һ��й©ʱ��ȷ�����������ǣ���ʪë����ס�ڱǣ����������������룻
�ʴ�Ϊ����ʪë����ס�ڱǣ����������������룮
��Һ©�����Կ��Ʒ�Ӧ���ٶȣ�Һ��й©ʱ��������ˮ�ķ�����ȥ�����еİ�����˵��������������ˮ���������ʣ������°���һ�ֿ�ȼ���壬�����ѵ�ȼ����ը����Ϊ16%��25%��������ȼŨ��Ϊ17%����ȡװ�ð������ȺͲ���������֣������˫��ˮ�Ͷ��������������Ͳ���Ҫ���ȣ�����ø�����ػ����������������Ҫ���ȣ��������ܶȱȿ������ܶȴ�������ˮ��������������ſ���������ˮ���ռ���ʵ���ҳ����Ȼ�粒������ʯ�ҹ��干����ȡ�����������Ҫ���ȣ������£�������NH3����һ����ɫ���д̼�����ζ�����壬�ܶȱȿ���С��������ˮ�����ֻ���������ſ������ռ�������Һ��й©ʱ��ȷ�����������ǣ���ʪë����ס�ڱǣ����������������룮

����Ŀ���������Ƽ��������ԭ���ǣ��Ƚ�����ͨ�뱥��ʳ��ˮ�У��ٽ�ѹ���Ķ�����̼ͨ�뱥�͵İ���ˮ���õ�̼�����ƾ��壬����õ���̼�����ƾ��������ȷֽ���Ƶô�� 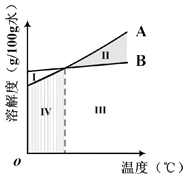
NaCl��NH4Cl���ܽ�ȱ���
�¶ȣ��棩 | 0 | 10 | 20 | 30 | 40 | 50 | |
�ܽ�� | NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 37 |
NH4Cl | 29.4 | 33.3 | 37.2 | 41.4 | 45.8 | 50.4 | |
������ṩ����Ϣ���ش����⣺
��10��ʱ��NaCl���ܽ������
��ͼ�У���ʾNH4Cl���ܽ�����������A����B����
�۳���20��ʱ�����Ƶı���ʳ��ˮ����������Ϊ �� ��ʳ��ˮ���¶���ߣ���Һ�����ʵ���������Ҳ����ߣ���ʵ�������������ڳ����½��У�����������������
����NaCl��NH4Cl��Һ��������������ͬ����ʾ�䱥��״̬�ĵ���ͼ�п���λ�ڵ���������ѡ�� I��II��III��IV����
��������ͨ�백����������̼����Ҫ�����Щ������ܽ�ȣ������������е�����ѡ���ţ�
A������ѹǿ B�������¶� C������ˮ����