题目内容
(6分)某研究性学习小组查阅资料得知:
焦炭(主要成分是碳单质,杂质不与水反应)与水蒸气在高温条件下反应,能产生一种俗称为水煤气的气体燃料(水煤气中不含甲烷等有机物)。
为探究水煤气的成份,该小组开展了如下活动:
(1)设计焦炭与水蒸气反应的装置,见图1(图中夹持仪器和加热仪器已省略)。
(2)作出假设:依据所学知识分析,水煤气中一定含有水蒸气,可能含有H2、CO、CO2。
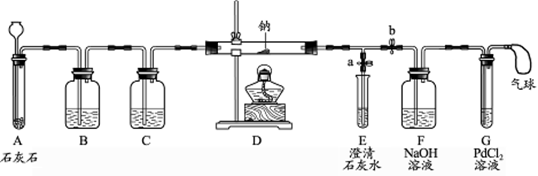
(3)实验探究:同学们为探究水煤气的成份,设计了如下实验装置(图2)并进行实验。

请分析图2所示装置的实验原理,填写下表中的空格:
(4)结果分析:实验证明水煤气中有H2、CO、CO2。
①能证明CO2存在的现象是 。②能证明CO存在的现象是 。
③能证明H2存在的现象是 。
焦炭(主要成分是碳单质,杂质不与水反应)与水蒸气在高温条件下反应,能产生一种俗称为水煤气的气体燃料(水煤气中不含甲烷等有机物)。
为探究水煤气的成份,该小组开展了如下活动:
(1)设计焦炭与水蒸气反应的装置,见图1(图中夹持仪器和加热仪器已省略)。
(2)作出假设:依据所学知识分析,水煤气中一定含有水蒸气,可能含有H2、CO、CO2。
(3)实验探究:同学们为探究水煤气的成份,设计了如下实验装置(图2)并进行实验。

请分析图2所示装置的实验原理,填写下表中的空格:
| 仪器编号 | 所盛试剂的名称 | 试剂或装置的作用 |
| A | | 检验是否有CO2 |
| B | 浓硫酸 | 吸收水分 |
| C | | |
| D | | |
①能证明CO2存在的现象是 。②能证明CO存在的现象是 。
③能证明H2存在的现象是 。
| 仪器编号 | 所盛试剂的名称 | 试剂或装置的作用 |
| A | 澄清石灰水 | |
| B | | |
| C | | 检验有水生成,证明水煤气中含有氢气 |
| D | | 检验有二氧化碳生成,证明水煤气中含有一氧化碳 |
③C处烧杯壁上有小液(水)滴出现。
试题分析:(3)根据二氧化碳能使澄清石灰水变浑浊可以判断,A中盛放的试剂是澄清石灰水;由于氢气燃烧生成水,故可以看到烧杯内壁上有水珠出现,从而证明水煤气中含有氢气;由于一氧化碳燃烧生成二氧化碳,二氧化碳能使澄清石灰水变浑浊,从而证明水煤气中含有二氧化碳。
(4)二氧化碳能使澄清石灰水变浑浊,A中石灰水变浑浊可以证明二氧化碳的存在;一氧化碳燃烧生成二氧化碳,二氧化碳能使澄清石灰水变浑浊,D中石灰水变浑浊能证明CO存在;因为氢气燃烧生成水,看到C中烧杯内壁上有水珠出现,能证明H2存在。
点评:对于此类验证型实验探究,要熟记物质的性质或变化规律,根据给出的实验设计方案,进行实验、分析和探究,并通过观察、记录和分析的实验现象,来验证该物质的性质或变化规律等。

练习册系列答案
相关题目