题目内容
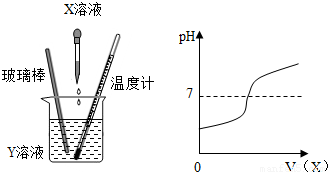
将X溶液滴入Y溶液中,在滴加过程中,Y溶液的pH变化情况如图所示:
| 溶液 | A | B | C | D |
| X | 盐酸 | 氢氧化钠 | 盐酸 | 氢氧化钠 |
| Y | 水 | 水 | 氢氧化钠 | 盐酸 |
(2)写出该反应的化学方程式为 .
(3)随着X溶液的不断滴入,该烧杯中溶液的温度变化是 .
(4)在Y溶液中滴入石蕊试剂,若不断滴入X溶液,石蕊的变化是 .
(5)当X和Y恰好完全反应时,溶液中的溶质是 ,若要从这溶液中获得大量晶体,应该采用 .
【答案】分析:(1)根据pH值变化情况图,分析溶液酸碱度变化的特点,并与所提供物质组进行对比,判断正确的组合;
(2)根据上述组合的物质发生反应的反应原理书写化学方程式;
(3)根据温度计的变化及中和反应放热分析;
(4)分析石蕊试剂在酸、碱、中性溶液中颜色变化,并结合化学反应分析;
(5)根据反应的反应原理分析,并据氯化钠的溶解度随温度的变化情况分析.
解答:解:(1)开始时溶液的pH小于7,显酸性,后来溶液的pH大于7,显碱性,说明是将碱性溶液加入到酸性溶液中;
(2)氢氧化钠能与盐酸反应生成氯化钠和水,反应方程式是:NaOH+HCl═NaCl+H2O;
(3)中和反应都是放热反应,故烧杯中溶液的温度随着反应的进行逐渐升高,当反应完全后,溶液的温度逐渐降低;
(4)由图象可知,溶液由酸性到中性,再由中性到碱性,石蕊试液在酸性溶液中为红色,在中性溶液中为紫色,在碱性溶液中为蓝色;
(5)氢氧化钠与盐酸反应生成氯化钠和水,故二者恰好反应时得到的是氯化钠溶液,溶质是氯化钠;氯化钠的溶解度随温度变化不大,故要从溶液中获得大量晶体,应该采用蒸发溶剂的方法;
故答案为:(1)D;开始时溶液pH<7,说明Y溶液显酸性则X显碱性(合理均可);
(2)NaOH+HCl═NaCl+H2O;
(3)先升高后降低;
(4)由红色到紫色,再由紫色到蓝色;
(5)氯化钠(NaCl);蒸发溶剂.
点评:本题难度不是很大,主要考查了中和反应及其应用,掌握溶液的酸碱性和溶液pH大小之间的关系、从数形结合的角度理解中和反应是正确解答本题的关键.
(2)根据上述组合的物质发生反应的反应原理书写化学方程式;
(3)根据温度计的变化及中和反应放热分析;
(4)分析石蕊试剂在酸、碱、中性溶液中颜色变化,并结合化学反应分析;
(5)根据反应的反应原理分析,并据氯化钠的溶解度随温度的变化情况分析.
解答:解:(1)开始时溶液的pH小于7,显酸性,后来溶液的pH大于7,显碱性,说明是将碱性溶液加入到酸性溶液中;
(2)氢氧化钠能与盐酸反应生成氯化钠和水,反应方程式是:NaOH+HCl═NaCl+H2O;
(3)中和反应都是放热反应,故烧杯中溶液的温度随着反应的进行逐渐升高,当反应完全后,溶液的温度逐渐降低;
(4)由图象可知,溶液由酸性到中性,再由中性到碱性,石蕊试液在酸性溶液中为红色,在中性溶液中为紫色,在碱性溶液中为蓝色;
(5)氢氧化钠与盐酸反应生成氯化钠和水,故二者恰好反应时得到的是氯化钠溶液,溶质是氯化钠;氯化钠的溶解度随温度变化不大,故要从溶液中获得大量晶体,应该采用蒸发溶剂的方法;
故答案为:(1)D;开始时溶液pH<7,说明Y溶液显酸性则X显碱性(合理均可);
(2)NaOH+HCl═NaCl+H2O;
(3)先升高后降低;
(4)由红色到紫色,再由紫色到蓝色;
(5)氯化钠(NaCl);蒸发溶剂.
点评:本题难度不是很大,主要考查了中和反应及其应用,掌握溶液的酸碱性和溶液pH大小之间的关系、从数形结合的角度理解中和反应是正确解答本题的关键.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
(4分)将X溶液滴入Y溶液中,在滴加过程中,Y溶液的pH变化情况如图所示:
| 溶液 | A | B | C | D |
| X | 盐酸 | 氢氧化钠 | 盐酸 | 氢氧化钠 |
| Y | 水 | 水 | 氢氧化钠 | 盐酸 |
(2)写出该反应的化学方程式为 。
(3)随着X溶液的不断滴入,该烧杯中溶液的温度变化是 。
(4)在Y溶液中滴入石蕊试剂,若不断滴入X溶液,石蕊的变化是 。
(5)当X和Y恰好完全反应时,溶液中的溶质是 ,若要从这溶液中获得大量晶体,应该采用 。
 将X溶液滴入Y溶液中,在滴加过程中,Y溶液
将X溶液滴入Y溶液中,在滴加过程中,Y溶液
的pH变化情况如图所示:
| 溶液 | A | B | C | D |
| X | 盐酸 | 氢氧化钠 | 盐酸 | 氢氧化钠 |
| Y | 水 | 水 | 氢氧化钠 | 盐酸 |
(2)写出该反应的化学方程式为______.
(3)随着X溶液的不断滴入,该烧杯中溶液的温度变化是______.
(4)在Y溶液中滴入石蕊试剂,若不断滴入X溶液,石蕊的变化是______.
(5)当X和Y恰好完全反应时,溶液中的溶质是______,若要从这溶液中获得大量晶体,应该采用______.
 将X溶液滴入Y溶液中,在滴加过程中,Y溶液
将X溶液滴入Y溶液中,在滴加过程中,Y溶液 将X溶液滴入Y溶液中,在滴加过程中,Y溶液的pH值变化情况如图所示.试推断X的化学式为
将X溶液滴入Y溶液中,在滴加过程中,Y溶液的pH值变化情况如图所示.试推断X的化学式为