题目内容
【题目】金属是现代生活和工业生产中应用极为普遍的一类材料。

(1)图甲是金属的一个应用实例,利用了金属的_______性。
(2)图乙是黄铜和纯铜片两块金属片相互刻划后,在纯铜片上有明显的划痕。该实验说明黄铜的硬度______(填“>”或“<”)纯铜的硬度。
(3)铝是一种活泼金属但常温下铝却有较强的抗腐蚀性,其原因是_______;(用化学方程式表示)
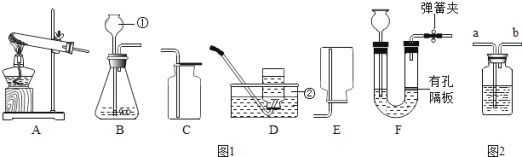
(4)某兴趣小组对“制镁企业不能使用CO2灭火器作为消防器材”的问题进行探究,请你参与他们的活动。
(实验操作)小组同学将点燃的镁条插入盛满CO2的集气瓶内,镁条继续剧烈燃烧,生成白色固体并有黑色物质附着于集气瓶内壁。同学们对镁与CO2反应的产物继续进行探究。
(提出猜想)Ⅰ:产物是MgO和C;
Ⅱ:产物是MgC2和C;
III:产物是MgO、MgC2和C。
某同学提出猜想Ⅱ一定是错误的,其依据是______。
(查阅资料)MgO+H2O![]() Mg(OH)2,Mg+2H2O
Mg(OH)2,Mg+2H2O![]() Mg(OH)2+H2↑
Mg(OH)2+H2↑
MgC2+2H2O=Mg(OH)2+C2H2↑。C2H2为可燃性气体。
(实验分析)为探究白色固体的成分,兴趣小组同学进行了如下实验:
① 取少量反应后的固体混合物放入试管,加入足量热水,无气体放出,说明猜想______不正确;
② 请根据正确的猜想写出Mg与CO2反应的化学方程式________。
(实验反思)通过本实验,金属镁着火时,可以采用灭火方法是:______。(填字母)
A 用水浇灭 B 用CO2灭火 C 用沙子灭火
(5)某同学为验证锌的化学性质比铁活泼,设计了两个实验(如下图)所示:
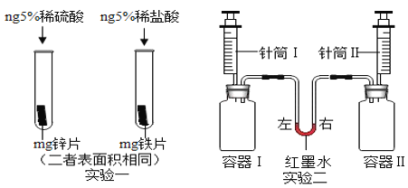
①实验一中,小明以“金属表面产生气泡的快慢”为标准来判断,有同学认为不够合理,理由是_______。
②实验二中,针筒I、II内各有15mL盐酸(足量且溶质质量分数相同),容器I内有m g锌片、容器II内有m g铁片(二者表面积相同),同时将针筒内全部盐酸迅速注入容器中,红墨水的位置变化情况是:开始______(填“左高右低”、“左右相平”或“左低右高”,下同),最终_______。
(6)生活中使用的金属材料基本是合金,合金中各成分的比例会影响合金的性能。某兴趣小组对生铁的组成进行研究。称取生铁样品40g,把400g稀硫酸分4次加入样品中,测得实验数据见下表(生铁中的杂质不溶于水,也不和稀硫酸反应):
实验序号 | 加入稀硫酸的质量/g | 剩余固体的质量/g |
第1次 | 100 | 28.8 |
第2次 | 100 | 17.6 |
第3次 | 100 | m |
第4次 | 100 | 1.2 |
试计算:①第3次剩余固体的质量m=______g;
②该生铁样品中铁的质量分数为______。
【答案】导热性 > 4Al+3O2==2Al2O3 生成物中没有O元素,不符合质量守定律 猜想Ⅲ 2Mg+CO2==2MgO+C C 有2个变量(合理答案均可) 左低右高 左高右低 6.4g 97%
【解析】
(1)图A是金属可以用作炊具,是利用了金属的导热性。
(2)图B是黄铜和纯铜片两块金属片相互刻划后,在纯铜片上有明显的划痕。该实验说明黄铜的硬度大于铜的硬度。
(3)铝是一种活泼金属,但常温下铝却有较强的抗腐蚀性,其原因是铝和氧气反应生成了致密的氧化铝保护膜,反应的化学方程式为:4Al+3O2==2Al2O3。
(4)猜想Ⅱ一定是错误的,其依据是质量守恒定律,化学反应前后元素的种类不变。
实验
①取少量反应后的固体混合物放人试管,加入足量热水,无气体放出,说明猜想Ⅲ不正确;
②猜想I是正确的,Mg与CO2反应生成氧化镁和碳,反应的化学方程式为:2Mg+CO2![]() 2MgO+C。
2MgO+C。
实验反思:
通过本实验,金属镁着火时,可以采用的灭火方法是用沙子灭火。故选C;
(5)①实验一中,小明以“金属表面产生气泡的快慢”为标准来判断,有同学认为不够合理,理由是反应物中的酸不同,一个是稀硫酸,一个是稀盐酸,因此无法比较反应速率。
②实验二中,同时将针筒内全部盐酸迅速注入容器中,红墨水的变化情况是:开始时,锌和稀盐酸反应的速率快,单位时间内产生的氢气多,因此红墨水是左低右高;最终由于铁和稀盐酸反应生成的氢气多于锌和稀盐酸反应生成的氢气,因此红墨水是左高右低。
(6)①由第一次反应可知,100g稀硫酸能和11.2g铁反应,第四次反应后剩余1.2g固体,则前三次反应后,固体均减少11.2g,则m=17.6g-11.2g=6.4g;
②第四次又加入100g稀硫酸充分反应后,剩余固体1.2g,固体减少:6.4g-1.2g=5.2g,说明生铁中的铁已完全与酸反应,铁的质量为:40g-1.2g=38.8g,则该生铁样品中铁的质量分数为![]() ×100%=97%。
×100%=97%。

 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案【题目】下图是用氯化钠溶液和氯化钾溶液制取氯酸钾的工艺流程,请根据题意回答下列问题。
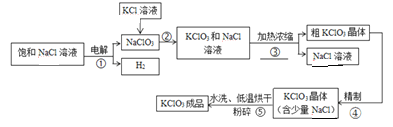
【资料】氯酸钾和氯化钠部分温度下的溶解度如下:
10℃ | 20℃ | 30℃ | 40℃ | |
氯酸钾 | 5.0g | 7.4g | 10.0g | 14.0g |
氯化钠 | 35.8g | 36.0g | 36.3g | 36.6g |
(1)请写出步骤②的化学方程式_________,该反应的基本反应类型是_________________。
(2)步骤③的操作分别是_________、过滤(填操作名称)。
(3)步骤⑤中是采用20℃以下的水进行洗涤,目的是①除去少量氯化钠②_____________。
(4)步骤⑤采用低温烘干,为什么不采用高温烘干___________________________(用化学方程式表示)。