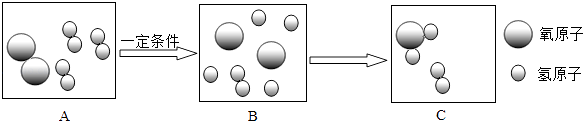
��Ŀ����
����Ŀ������ͬѧΪ�ⶨһ�������������Ȼ��غ�̼��ص�����������������ʵ�飬�ش������й����⣨ע������ˮ������ȫ���ܽ⣩ 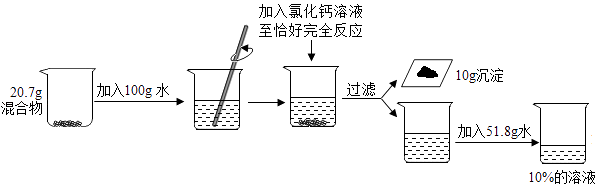
��1��ʵ���з�����Ӧ�Ļ�ѧ����ʽΪ
��2����������Ȼ��ص�������x���ı���ʽΪ
��3����������Ȼ��غ�̼������������������
��4����������˵���μ��Ȼ�����Һ�������̣��ձ��и����������ı仯���
��5�������Ȼ�����Һ�����ʵ���������Ϊ ��
���𰸡�
��1��K2CO3+CaCl2=CaCO3��+2KCl
��2��![]() =
= ![]()
��3��1��2
��4���Ȼ���������6.9g���ӵ�21.8g,��̼���������13.8g������0g
��5��20%
���������⣺������м����Ȼ���ֻ��̼��غ��Ȼ��Ʒ�Ӧ����̼��ƺ��Ȼ��أ���Ӧ�Ļ�ѧ����ʽΪK2CO3+CaCl2=CaCO3��+2KCl��
�����ɵ��Ȼ��ص�����Ϊx���μӷ�Ӧ��̼��ص�����Ϊy�����ĵ��Ȼ��Ƶ�����Ϊz
K2CO3+ | CaCl2= | CaCO3��+ | 2KCl |
138 | 111 | 100 | 149 |
y | z | 10g | x |
![]() =
= ![]()
x=14.9g
![]() =
= ![]() =
= ![]()
y=13.8g
z=11.1g
��������Ȼ��غ�̼�����������������ȣ�20.7g��13.8g����13.8g=1��2
��Ӧ���Ȼ��ص�������Ϊ20.7g��13.8g+14.9g=21.8g
�μ��Ȼ�����Һ�������̣��ձ��и����������ı仯��� �Ȼ���������6.9g���ӵ�21.8g����̼���������13.8g������0g
��Ӧ��������Һ��������Ϊ21.8g��10%=218g
�����Ȼ�����Һ������Ϊ218g+10g��51.8g��100g��20.7g=55.5g
�����Ȼ�����Һ�����ʵ���������Ϊ ![]() ��100%=20%
��100%=20%
�𣺣�1��ʵ���з�����Ӧ�Ļ�ѧ����ʽΪ K2CO3+CaCl2=CaCO3��+2KCl��2����������Ȼ��ص�������x���ı���ʽΪ ![]() =
= ![]() ��3����������Ȼ��غ�̼������������������ 1��2��4����������˵���μ��Ȼ�����Һ�������̣��ձ��и����������ı仯��� �Ȼ���������6.9g���ӵ�21.8g����̼���������13.8g������0g��5�������Ȼ�����Һ�����ʵ���������Ϊ 20%��
��3����������Ȼ��غ�̼������������������ 1��2��4����������˵���μ��Ȼ�����Һ�������̣��ձ��и����������ı仯��� �Ȼ���������6.9g���ӵ�21.8g����̼���������13.8g������0g��5�������Ȼ�����Һ�����ʵ���������Ϊ 20%��
�����㾫�������ø��ݻ�ѧ��Ӧ����ʽ�ļ������Ŀ�����жϼ��ɵõ��𰸣���Ҫ��֪�����ʼ�������=ϵ������Է�������֮�ȣ�