题目内容
【题目】下列曲线正确的是( )
A. 向等体积、等浓度的稀盐酸中加金属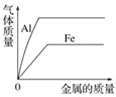
B. 向稀硝酸中加水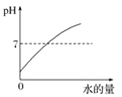
C. 双氧水分解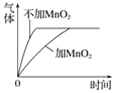
D. 向等体积、等浓度的稀盐酸中加金属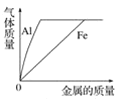
【答案】D
【解析】
相等质量、等浓度的稀盐酸中加入金属,在初始阶段,由于金属是少量的,会完全参加反应,酸剩余,计算时应按照完全参加反应的金属来计算,根据化学方程式可知,产生的氢气是铝>铁;后来金属逐渐增加直至过量,此时就是酸完全参加反应,金属剩余,计算时应按照完全参加反应的酸来计算,根据化学方程式,产生的氢气相等,故A项错误,D项正确;
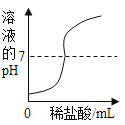
B、向稀硝酸中加水,只是起稀释作用,并不能改变溶液的酸碱性,故图像所显示的pH会逐渐接近7却不会超过7,图像错误;
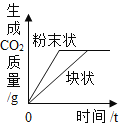
C、在双氧水的分解过程中,二氧化锰起催化作用,在这里会加快双氧水的分解,即相同时间内加二氧化锰的双氧水分解应更快,图像错误。
故选D。

练习册系列答案
相关题目
【题目】下列图像不能正确反映其对应操作的是
A | B | C | D |
|
|
|
|
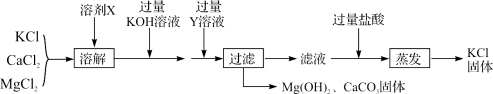
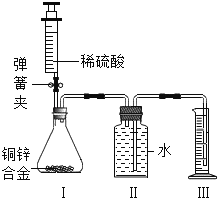
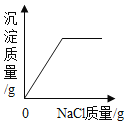
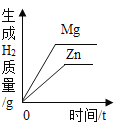
在一定量的AgNO3溶液中逐滴加入NaCl溶液 | 等质量Zn和Mg分别与足量的等浓度稀硫酸反应 | 向NaOH溶液中逐滴加入稀盐酸 | 等质量CaCO3分别与足量的等浓度稀盐酸反应 |
A. A B. B C. C D. D