��Ŀ����
����Ŀ�������ܽ���ѧϰ��ѧ�ij��÷�������ͼ�������벻ͬ�������֮�䷴Ӧ��֪ʶ���硣��ش��������⣺
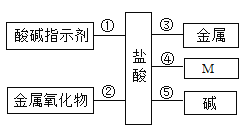
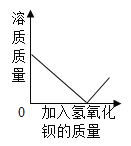
��1�������pH_____7�����������=������ ���ᡢ����������ƻ�ѧ��������������ˮ��Һ�ж�����_____���ӣ�д���ţ���
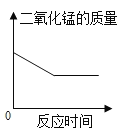
��2������ɳ�ȥ����Ʒ��������⣨��Ҫ�ɷ�Fe2O3������÷�Ӧ�Ļ�ѧ����ʽΪ___________��
��3��д��һ�ֽ����������ᷴӦ�Ļ�ѧ����ʽΪ___________________��
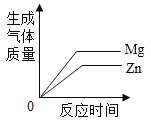
��4����������Ļ�ѧ������Ţ��л�ѧ��Ӧ�Ĺ���Ϊ_________________��
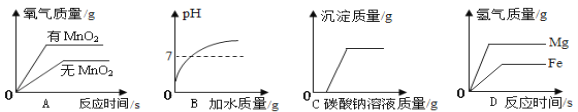
��5�����������������Һ��Ӧ����_______��Ӧ��������ȡ������ȡ�����
���𰸡��� H+ 6HCl+Fe2O3=2FeCl3+3H2O Mg+2HCl= MgCl2+H2���� ���������η�Ӧ������������� ����
��������
��1��������һ���ᣬ��Һ�����ԣ�pHС��7�����������������ƵĻ�ѧ����������������ˮ��Һ�ж��ܵ���������ӡ��ʴ�Ϊ������H+��
��2���������Ҫ�ɷ�������������������ϡ���ᷴӦ�����Ȼ�����ˮ���ʴ�Ϊ��6HCl+Fe2O3=2FeCl3+3H2O��
��3��������������ϡ���ᷴӦ����ý���Ӧ�����ڻ��˳����У�����ǰ�Ľ��������ء��ơ��ƣ����������þ������п�����ȡ��ʴ�Ϊ��Mg+2HCl= MgCl2+H2���ȣ��𰸺������ɣ���
��4�����������ѧ�����ǣ����������ָʾ�����ã���������ý������ʷ�Ӧ�����κ�������������Ӧ�����κ�ˮ���������η�Ӧ������������Σ���������������ﷴӦ�����κ�ˮ��������Ʋ��MӦ�����������ʡ��ʴ�Ϊ�����������η�Ӧ������������Σ�
��5��ϡ������������Ʒ�Ӧ�����Ȼ��ƺ�ˮ���÷�Ӧ���кͷ�Ӧ����Ӧ�������������ų����ʴ�Ϊ�����ȡ�

 ������ȫ��������ϵ�д�
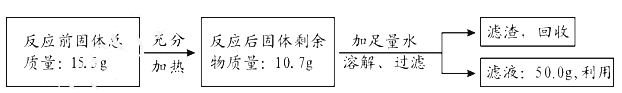
������ȫ��������ϵ�д�����Ŀ��ʵ������̼������Һ���Ȼ�����Һ��Ӧ��ȡ�ߴ���̼��Ʒ�ĩ���ձ�������100g̼������Һ����150g�Ȼ�����Һ���Ĵμ��룬��ַ�Ӧ���Ĵβ��������������±���ʾ��
���� | �ۼƼ����Ȼ�����Һ������/g | �ձ�����Һ��������/g |
һ | 40 | 134 |
�� | 80 | 168 |
�� | 120 | 202 |
�� | 150 | 232 |
(1)ǡ����ȫ��Ӧʱ�����ɳ�����������Ϊ____g��
(2)���Ĵβ���ʱ��������Һ�е�������_______(�ѧʽ)��
(3)�����Ȼ�����Һ��������������Ϊ______________(д���������)��