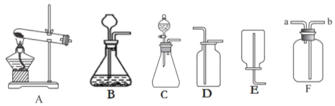
题目内容
【题目】将4.9g氯酸钾与1.5g二氧化锰混合加热,制得所需氧气后停止实验,剩余固体质量为5.0g。计算;
(1)生成氧气的质量______。
(2)4.9g氯酸钾是否完全分解______?
(3)剩余固体中钾元素的质量分数________。
【答案】1.4g 没有完全分解 15.6%
【解析】
(1)依据质量守恒定律可知:制得氧气的质量为:4.9g+1.5g﹣5.0g=1.4g,
(2)解:设已经分解的氯酸钾的质量为x,
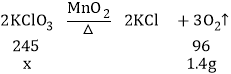
![]()
x≈3.57g
则4.9g氯酸钾没有完全分解。
(3)钾元素的质量化学反应前后没有变化,故反应后的钾元素质量是4.9g×39/245=0.78g,则剩余固体中钾元素的质量分数为0.78g×5.0g×100%=15.6%;
答:(1)生成氧气的质量是1.4g。
(2)4.9g氯酸钾没有完全分解。
(3)剩余固体中钾元素的质量分数为15.6%

练习册系列答案
相关题目
【题目】空气是宝贵的然资源。
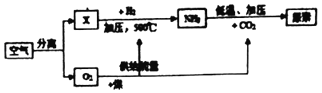
下表是空气,如图是以空气、煤等为原料合成尿素(化学式;CO(NH2)2)的流程(部分产物已略去)。请按要求回答相关问题:
空气组成 | N | R | Q | CO | 其它 |
体积分数 | 78% | 21% | 0.93% | 0.034% | 0.02% |
(1)上表中R的名称是_____;
(2)物质X和H2合成氨气的化学方程式是_____;该反应属于_____反应(填基本反应类型)。
(3)分离空气的常用方法有以下两种。
Ⅰ.将空气液化后再气化,液态空气气化时首先分离出氮气。则比较二者的沸点:N2_____O2(选填“高于”“等于”或“低于”)。
Ⅱ.用分子筛分离。分子筛是一种内部分布有均匀微小孔径的固体,通过特制的分了筛把空气中的氧分子吸入孔穴而与其它分子分离,则分子大小;N2_____O2(选填“大于”“等于”或“小于”)。