题目内容
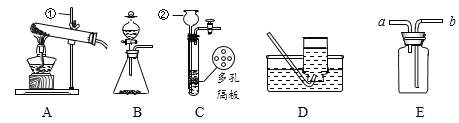
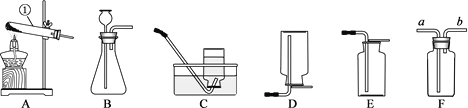
【题目】葡萄酒常用焦亚硫酸钠(Na2S2O5)作防腐剂。某研究小组采用如图装置(实验前已除尽装置内的空气)制取Na2S2O5。装置II中有Na2S2O5晶体析出,发生的反应:Na2SO3+SO2=Na2S2O5。
查阅资料:①SO2与CO2类似,能与水、NaOH溶液反应。
②亚硫酸(H2SO3)类似碳酸不稳定,易分解。
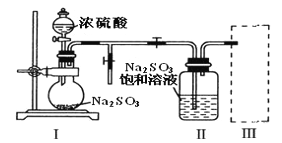
(1)装置I中Na2SO3和硫酸发生复分解反应产生SO2气体的化学方程式为_______。
(2)将装置II中析出的晶体从溶液中分离出来的操作名称是____________。
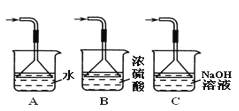
(3)装置III用于处理尾气SO2,可选用图中最合理装置为_______(填编号)。
(4)Na2S2O5溶于水即生成NaHSO3。证明NaHSO3溶液呈酸性,可采用的实验方法是_______(填编号)。
a.加入盐酸b.加入酚酞溶液c.测定溶液的pH
(5)测定某葡萄酒中防腐剂的残留量(以SO2计算)的原理:
I2+SO2+2H2O=H2SO4+2HI,利用消耗的I2量可求SO2量。在实验过程中,若有部分HI变为I2,则测定结果_______(填“偏高”“偏低”或“不变”)。
【答案】Na2SO3+H2SO4=Na2SO4+H2O+SO2↑ 过滤 C c 偏低
【解析】
(1)Na2SO3和硫酸反应生成硫酸钠、水和二氧化硫,故反应的化学方程式写为:Na2SO3+H2SO4=Na2SO4+H2O+SO2↑。
(2)将装置Ⅱ中析出的晶体从溶液中分离出来的操作名称是过滤,故填过滤。
(3)装置Ⅲ用于处理尾气SO2,因为氢氧化钠溶液能吸收二氧化硫,防止空气污染,可选用图2中最合理装置为C,故填C。
(4)证明NaHSO3溶液呈酸性,可采用的实验方法是测定溶液的pH,pH小于7溶液就显酸性,故填c。
(5)在实验过程中,若有部分HI变为I2,则测定结果偏低,因为消耗原来的I2量较少了,故填偏低。

【题目】某化学兴趣小组的同学为了测定石灰石中碳酸钙的质量分数,称取了5份石灰石样品(杂质不与稀盐酸反应),分别加入过量的稀盐酸进行实验,结果如下:
实验 | 1 | 2 | 3 | 4 | 5 |
石灰石样品的质量/g | 1.25 | 2.50 | 5.00 | 6.25 | 7.50 |
生成CO2的质量/g | 0.44 | 0.88 | 1.66 | 2.20 | 2.64 |
分析上述实验数据并回答:
(1)第______次实验数据有明显错误,理由是________________;
(2)计算这种石灰石样品中碳酸钙的质量分数______。