题目内容
【题目】写出下列反应的化学方程式,并进行方程式配平。
(1)铁丝在氧气中燃烧_______________________________。
(2)高锰酸钾受热分解_______________________________。
(3)有水生成的分解反应_______________________________。
(4)_______C3H6+_______O2![]() _______CO2+_______H2O。
_______CO2+_______H2O。
(5)_______Fe2O3+_______CO![]() _______Fe+_______CO2。
_______Fe+_______CO2。
【答案】3Fe+2O2![]() Fe3O4 2KMnO4
Fe3O4 2KMnO4![]() K2MnO4+MnO2+O2↑ 2H2O2
K2MnO4+MnO2+O2↑ 2H2O2![]() 2H2O+O2↑ 2 9 6 6 1 3 2 3
2H2O+O2↑ 2 9 6 6 1 3 2 3
【解析】
(1)铁丝在氧气中燃烧生成四氧化三铁,反应的化学方程式为:3Fe+2O2![]() Fe3O4。(2)高锰酸钾受热分解生成锰酸钾、二氧化锰和氧气,反应的化学方程式:2KMnO4
Fe3O4。(2)高锰酸钾受热分解生成锰酸钾、二氧化锰和氧气,反应的化学方程式:2KMnO4![]() K2MnO4+MnO2+O2↑。(3)有水生成的分解反应,如双氧水分解生成水和氧气,反应的化学方程式:2H2O2
K2MnO4+MnO2+O2↑。(3)有水生成的分解反应,如双氧水分解生成水和氧气,反应的化学方程式:2H2O2![]() 2H2O+O2↑。(4)根据质量守恒定律,利用定一法可配平:C3H6+
2H2O+O2↑。(4)根据质量守恒定律,利用定一法可配平:C3H6+![]() O2
O2![]() 3CO2+3H2O,然后同乘以2得该反应的化学方程式为2C3H6+9O2
3CO2+3H2O,然后同乘以2得该反应的化学方程式为2C3H6+9O2![]() 6CO2+6H2O。(5)根据质量守恒定律,和观察法可配平:Fe2O3+3CO
6CO2+6H2O。(5)根据质量守恒定律,和观察法可配平:Fe2O3+3CO![]() 2Fe+3CO2。
2Fe+3CO2。

 阳光考场单元测试卷系列答案
阳光考场单元测试卷系列答案 名校联盟冲刺卷系列答案
名校联盟冲刺卷系列答案 名校提分一卷通系列答案
名校提分一卷通系列答案 课程达标测试卷闯关100分系列答案
课程达标测试卷闯关100分系列答案【题目】重庆凤中的同学们在学习了催化剂的知识后提出:氧化铁固体(Fe2O3,难溶于水)在双氧水制氧气的反应中能否起到类似二氧化锰的催化作用呢?于是进行了以下探究:
(猜想)Ⅰ、Fe2O3既不是催化剂,也不是反应物,反应前后质量和化学性质不变;
Ⅱ、Fe2O3是反应物,要生成O2,反应前后质量和化学性质要改变;
Ⅲ、Fe2O3是该反应的催化剂,反应前后_____;
(实验)用天平称量1g Fe2O3固体,取10mL10%的双氧水于试管中,进行实验:

(1)实验过程中记录现象如下:
步骤①现象 | 步骤③现象 | 步骤⑥ | 结论 |
无明显变化 | _____ | 称得固体质量为1g | 猜想Ⅲ成立. |
(2)老师指出上述实验不能证明Fe2O3是该反应的催化剂,理由是_____(填序号);
A 只有二氧化锰能起催化作用
B 未验证回收的固体是否仍是Fe2O3
C 未验证回收的固体的物理性质
D 未验证Fe2O3是否改变反应速率
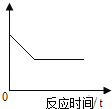
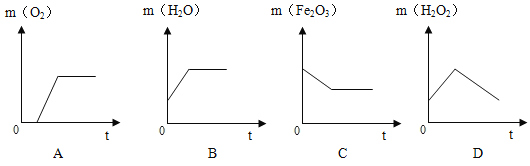
(3)步骤③中,试管中各物质质量随反应时间t变化曲线正确的是_____(填序号)。
【题目】学习了MnO2对过氧化氢分解有催化作用的知识后,某同学想:CuO能否起到类似MnO2的催化剂作用呢?于是进行了以下探究。
【猜想】Ⅰ、CuO不是催化剂、也不参与反应,反应前后质量和化学性质不变;
Ⅱ、CuO参与反应产生O2,反应前后质量和化学性质发生了改变;
Ⅲ、CuO是反应的催化剂,反应前后_____________________________。
【实验】用天平称量0.2gCuO,取5mL5%的过氧化氢溶液于试管中,进行如下实验:
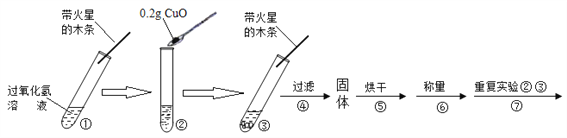
(1)填写下表:
步骤③现象 | 步骤⑥结果 | 步骤⑦现象 | 结论 |
________ 带火星的木条复燃。 | ______ | 溶液中有气泡放出,________ | 猜想Ⅰ、Ⅱ不成立; 猜想Ⅲ成立。 |
(2)步骤①的目的是___________________________________。
(3)步骤④需用到的实验仪器有:铁架台(带铁圈)、漏斗、烧杯、___________。
(4)过氧化氢能被CuO催化分解的化学方程式为_______________________。
【拓展】要探究步骤⑤做过催化剂的CuO其它化学性质,还应补做的实验是____。(写一种)