题目内容
【题目】回答下列有关的实验问题:
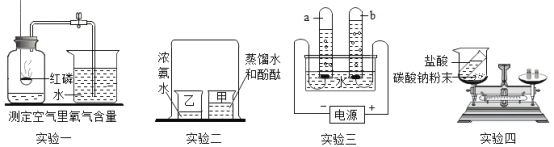
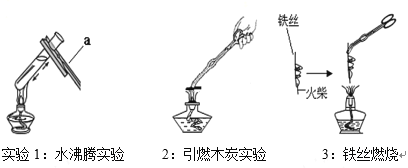
(1)实验一中,打开止水夹进入瓶中的水大于五分之一,其原因是_____________;
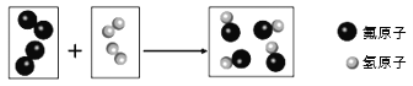
(2)实验二中,验证了分子具有的性质是___________________;
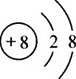
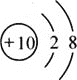
(3)实验三电解水过程中,正、负两极产生气体的体积比约为_________;质量比为________。
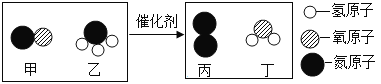
(4)实验四中发生的反应用化学方程式表示为:Na2CO3+2HCl=2NaCl+H2O+CO2↑。若用其验证质量守恒定律不能得到正确结论,在不更换药品的情况下改进,使其遵守质量守恒定律,你的改进方法是_______。
【答案】燃烧匙伸入集气瓶时太慢,反应过程中止水夹夹得不紧 分子是不断运动的 1:2 8:1 把盛有盐酸的试管放入盛有碳酸钠粉末、瓶口系有气球的锥形瓶中
【解析】
(1)原因:燃烧匙伸入集气瓶时太慢(导致瓶内部分气体膨胀逸出),反应过程中止水夹夹得不紧(导致瓶内部分气体通过导管膨胀逸出)。
故填:燃烧匙伸入集气瓶时太慢,反应过程中止水夹夹得不紧。
(2)实验二中,酚酞试液变红色,是因为氨分子运动到甲中,和水结合生成氨水,氨水使酚酞试液变红色,说明分子是不断运动的。
故填:分子是不断运动的。
(3)实验三电解水过程中,正、负两极产生气体(氧气、氢气)的体积比约为1:2,质量比为8:1。
故填:1:2;8:1。
(4)改进方法是:把盛有盐酸的试管放入盛有碳酸钠粉末、瓶口系有气球的锥形瓶中。
故填:把盛有盐酸的试管放入盛有碳酸钠粉末、瓶口系有气球的锥形瓶中。

练习册系列答案
相关题目