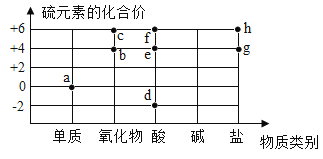
题目内容
【题目】如图所示的装置,常用于实验室制取CO2,并对它的部分性质进行探究,按要求回答问题。
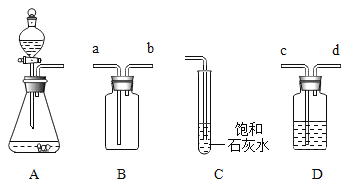
(1)实验室制取CO2的化学反应方程式为__________。
(2)用B装置收集CO2,气体应从________(选填“a”或“b”)端通入。
(3)往C试管中通入CO2时,观察到“饱和石灰水浑浊后变澄清”。该小组同学开展了如下活动:
(查阅文献)碳酸钙(碳酸钠等)与二氧化碳、水反应生成可溶于水的碳酸氢钙(碳酸氢钠等)。
(作出假设)1:所用盐酸浓度过高,挥发出的HCl气体使浑浊变澄清;
2:______________________________。
(设计方案)为除去CO2气体中的HCl气体,在图A和图C之间增加了图D装置。装置的连接顺序是A→_________→C(填“c→d”或“d→c”);其中盛放的试剂合理的是_____(填选项序号)。
①浓硫酸 ②NaOH溶液 ③饱和碳酸钠溶液 ④饱和碳酸氢钠溶液
(进行实验)向浑浊后的饱和石灰水中继续通入足量CO2,沉淀部分溶解但最终并未完全澄清。
(得出结论)假设1正确。
【答案】CaCO3+2HCl=CaCl2+H2O+CO2↑ a 产生的过量二氧化碳使浑浊最终变澄清 c→d ④
【解析】
(1)实验室制取CO2,碳酸钙和盐酸反应生成氯化钙、水和二氧化碳,化学反应方程式为:CaCO3+2HCl═CaCl2+H2O+CO2↑。
(2)用B装置收集CO2,二氧化碳密度比空气大,气体应从a端通入。
(3)[作出假设]
1:所用盐酸浓度过高,挥发出的HCl气体使浑浊变澄清;
2:生成的碳酸钙和水、二氧化碳反应生成碳酸氢钙,使浑浊变澄清。
[设计方案]
为除去CO2气体中的HCl气体,在图A和图C之间增加了图D装置。其中盛放的试剂合理的是饱和碳酸氢钠溶液,是因为碳酸氢钠和盐酸反应生成氯化钠、水和二氧化碳,且不和二氧化碳反应。①浓硫酸不和HCl气体反应,不能除去杂质;②NaOH溶液和CO2、HCl气体均能反应,除去杂质的同时,除去原气体;③饱和碳酸钠溶液能和氯化氢气体反应,但也能和二氧化碳反应生成碳酸氢钠,除去杂质的同时,除去原气体;故选④。
装置的连接顺序是A→c→d→C。气体从长管进入,短管出。

【题目】84消毒液、H2O2溶液都是常用消毒剂,兴趣小组对两种消毒剂进行了如下探究活动。
(查阅资料)84消毒液的有效成分是次氯酸钠(化学式为NaClO)。
(实验1)取少量84消毒液于试管中,滴加H2O2溶液,发现有大量气泡产生:然后___________(填写实验操作和现象),证明产生的气体是氧气。
(提出问题)在上述反应中,NaClO的作用是什么?
(作出猜想)猜想一:作反应物,NaClO与H2O2溶液发生化学反应;
猜想二:作____________,类似分解H2O2溶液制氧气时MnO2的作用
(实验2)
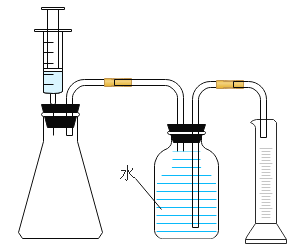
①按上图所示组装实验装置,并________。
②向锥形瓶中加入30mL84消毒液,注射器中吸入25mLH2O2溶液。
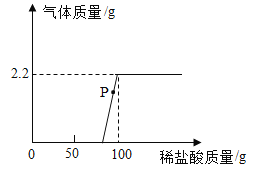
③将注射器中的H2O2溶液平均分5次推入锥形瓶中:每次推入H2O2溶液,待不再产生气泡后,记录收集气体的总体积(忽略其他因素对测量结果造成的影响)见下表。
第1次 | 第2次 | 第3次 | 第4次 | 第5次 | |
收集气体的总体积/mL | 140 | 280 | 365 | x | 375 |
(1)表中的数据x=_______。
(2)分析表中数据得出“猜想一正确”,其依据是______。
(分析讨论)NaClO与H2O2溶液反应除生成氧气外,还生成氯化钠和水。该反应的化学方程式为_____。
(拓展反思)生活中常用消毒剂除84消毒液、H2O2溶液外,还有75%酒精、过氧乙酸等。在使用各种消毒剂时,要考虑它们的性质。切记:科学使用,注意安全!
生活中下列使用消毒剂的做法正确的是_________。
A、不同的消毒剂可随意混合使用
B、使用84消毒液的浓度越高越好
C、使用75%酒精消毒应远离明火,防止火灾
D、84消毒液、75%酒精等消毒剂均应密封保存
【题目】实验室可利用Zn与稀硫酸的反应制取H2。
(1)用浓硫酸配制稀硫酸的操作为________(填字母),用玻璃棒引流,并不断搅拌。
A 将浓硫酸缓缓注入盛有水的烧杯中
B 水缓缓注入盛有浓硫酸的烧杯中
(2)Zn与稀硫酸反应的化学方程式为___________。
(3)图-1所示的仪器B、D的名称为__________、________,组装制取H2的发生装置应选用的仪器为_________(填字母)。

(4)为收集并准确测量H2的体积,在装入药品前,需检查装置的_______。
(5)相同条件下H2密度比空气小,利用该性质可以通过_________法收集H2,若用图-2所示装置测量生成H2的体积,H2应从____________(填“甲”或“乙”)管通入。
(6)为探究影响Zn与稀硫酸反应快慢的因素,进行以下三组实验,室温下,取颗粒大小相同的锌粒与足量的稀硫酸反应,测量产生10mLH2(通常状况)所需的时间,下表为实验数据:
实验编号 | 硫酸的质量分数/% | 硫酸的体积/mL | 锌粒的质量/g | 时间/s |
1 | 10 | 10 | 1 | 78 |
2 | 10 | 10 | 2 | 57 |
3 | 40 | 10 | 1 | 9 |
①比较实验1、2的数据,可以得出的结论是________。
②由实验数据可知,该实验中对Zn与稀硫酸反应快慢影响较大的因素是________。
③比较不同条件下锌粒与稀硫酸反应的快慢有不同的方法,除测量产生相同体积的H2所需的时间,还可采用的测量方法是___________(写出一种)。