题目内容
 工业上用碳酸钠溶液与石灰水反应制烧碱,对于碳酸钠溶液与石灰水是否恰好完全反应,某化学兴趣小组的同学将其产物进行过滤,并对滤液进行如下探究.
工业上用碳酸钠溶液与石灰水反应制烧碱,对于碳酸钠溶液与石灰水是否恰好完全反应,某化学兴趣小组的同学将其产物进行过滤,并对滤液进行如下探究.【提出问题】滤液中含有哪些溶质?
【猜想与假设】假设一:滤液中只含氢氧化钠
假设二:滤液中含氢氧化钠和碳酸钠
假设三:滤液中含有
假设四:滤液中含有氢氧化钠、氢氧化钙和碳酸钠
【进行实验】甲同学设计了如下实验方案:
| 实验步骤 | 实验现象 | 结论 |
| 取少量滤液放在试管中,再滴入氯化钙溶液 | 若生成白色沉淀 | 碳酸钠过量 |
| 若无明显现象 | 恰好反应 |
(1)碳酸钠溶液与石灰水反应的基本类型为
(2)乙同学认为假设四不合理,理由是
(3)丙同学认为甲同学设计方案还不能说明碳酸钠溶液和澄清石灰水恰好完全反应,她的理由是
(4)丁同学认为要说明碳酸钠溶液与石灰水是否恰好完全反应,还需在甲同学实验方案的基础上进行实验,她的实验方案是:
| 实验步骤 | 实现现象和结论 |
| 取少量甲同学实验用的原滤液放在试管中,通入足量的二氧化碳,观察 | |
(5)戊同学称取100g烧碱固体样品(样品中的杂质是碳酸钠),加水溶解得到溶液A,取A溶液的
| 1 |
| 5 |
①样品中氢氧化钠的质量为
②计算所加CaCl2溶液中溶质质量分数.(写出计算过程)
考点:实验探究物质的组成成分以及含量,有关溶质质量分数的简单计算,碱的化学性质,盐的化学性质,根据化学反应方程式的计算
专题:科学探究
分析:对反应后溶液中的物质进行假设,从两个方面来思考,一是恰好完全反应,二是有一种反应物过量,不可能两种反应物都过量;含碳酸钠杂质的氢氧化钠样品中加入稀盐酸,首先发生的是酸碱中和反应,其次才发生碳酸钠和盐酸的反应;样品中的碳元素最终都转化到了二氧化碳中,所以求样品中碳元素质量分数,要先找出二氧化碳中碳元素质量.
解答:解:【猜想与假设】碳酸钠溶液与石灰水,有三种情况:①恰好完全反应,滤液中只含有氢氧化钠,②碳酸钠过量,滤液中含氢氧化钠和碳酸钠,③氢氧化钙过量,滤液中含氢氧化钠和氢氧化钙;
(1)碳酸钠和氢氧化钙发生的是复分解反应,生成碳酸钙沉淀和氢氧化钠,属于复分解反应;
(2)很显然假设四不成立,因为碳酸钠和氢氧化钙是反应物,二者不可能都剩余;
(3)甲同学的方案不能说明碳酸钠溶液和澄清石灰水恰好完全反应,因为如果是假设二成立,过量的氢氧化钙和氯化钙也不反应,无现象;
(4)在甲同学实验方案的基础上,要说明碳酸钠溶液与石灰水恰好完全反应,应取甲同学实验后的清液放在试管中,再通入足量的二氧化碳,如果溶液变浑浊说明滤液中含氢氧化钙;如果溶液无变化说明不含氢氧化钙;
(5)①设碳酸钠的质量为x,CaCl2溶液中溶质质量为y;
Na2CO3+CaCl2═2NaCl2+CaCO3↓
106 111 100
x y 5g
=
x=5.3g
=
y=5.55g
样品中氢氧化钠的质量为100g-5.3g×5=73.5g
②所加CaCl2溶液中溶质质量分数为:
×100%=11.1%.
故答案为:【猜想与假设】假设三:氢氧化钠和氢氧化钙.
【反思与评价】
(1)复分解反应.
(2)因为氢氧化钙溶液与碳酸钠溶液不能共存.
(3)若氢氧化钙过量,滴加氯化钙溶液也无明显现象.
(4)
【定量研究】(5)①73.5;②11.1%.
(1)碳酸钠和氢氧化钙发生的是复分解反应,生成碳酸钙沉淀和氢氧化钠,属于复分解反应;
(2)很显然假设四不成立,因为碳酸钠和氢氧化钙是反应物,二者不可能都剩余;
(3)甲同学的方案不能说明碳酸钠溶液和澄清石灰水恰好完全反应,因为如果是假设二成立,过量的氢氧化钙和氯化钙也不反应,无现象;
(4)在甲同学实验方案的基础上,要说明碳酸钠溶液与石灰水恰好完全反应,应取甲同学实验后的清液放在试管中,再通入足量的二氧化碳,如果溶液变浑浊说明滤液中含氢氧化钙;如果溶液无变化说明不含氢氧化钙;
(5)①设碳酸钠的质量为x,CaCl2溶液中溶质质量为y;
Na2CO3+CaCl2═2NaCl2+CaCO3↓
106 111 100
x y 5g
| 106 |
| x |
| 100 |
| 5g |
x=5.3g
| 111 |
| y |
| 100 |
| 5g |
y=5.55g
样品中氢氧化钠的质量为100g-5.3g×5=73.5g
②所加CaCl2溶液中溶质质量分数为:
| 5.55g |
| 50g |
故答案为:【猜想与假设】假设三:氢氧化钠和氢氧化钙.
【反思与评价】
(1)复分解反应.
(2)因为氢氧化钙溶液与碳酸钠溶液不能共存.
(3)若氢氧化钙过量,滴加氯化钙溶液也无明显现象.
(4)
| 实 验 步 骤 | 实 验 现 象 和 结 论 |
| 取少量甲同学实验用的原滤液放在试管中,在通入足量的二氧化碳,观察 | 溶液无变化,则不含氢氧化钙 |
| 溶液变浑浊,则含氢氧化钙 |
点评:此题是有关反应后溶液中成分的探究题,其中又有根据方程式的计算题,步骤较多,做题过程比较繁琐,属于较难题型.

练习册系列答案
相关题目
学校安全无小事,下列做法可能造成安全事故的是( )
| A、扇闻气体的气味 |
| B、先预热,再给试管内的物质加热 |
| C、用灯帽盖灭酒精灯 |
| D、为了节约火柴,可用燃着的酒精灯点燃另一酒精灯 |
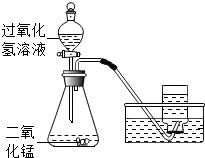 小明取34g过氧化氢溶液和二氧化锰制取氧气,实验的相关数据如下表:
小明取34g过氧化氢溶液和二氧化锰制取氧气,实验的相关数据如下表: