题目内容
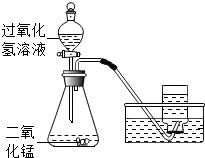 小明取34g过氧化氢溶液和二氧化锰制取氧气,实验的相关数据如下表:
小明取34g过氧化氢溶液和二氧化锰制取氧气,实验的相关数据如下表:| 气体发生装置内物质的总质量 | |
| 反应前 | 45.6g |
| 反应后 | 44.8g |
(2)计算该过氧化氢溶液的溶质质量分数,写出必要的计算过程.
考点:根据化学反应方程式的计算,有关溶质质量分数的简单计算
专题:溶质质量分数与化学方程式相结合的计算
分析:(1)根据质量守恒定律可以知道反应前后减少的质量即为生成氧气的质量,可以据此解答;
(2)根据生成氧气的质量结合过氧化氢分解的化学方程式可以求算出过氧化氢的质量及质量分数.
(2)根据生成氧气的质量结合过氧化氢分解的化学方程式可以求算出过氧化氢的质量及质量分数.
解答:解:(1)根据质量守恒定律可以知道反应前后减少的质量即为生成氧气的质量,即为:65.6g-64.8g=0.8g;
故填:0.8g;
(2)设参加反应的过氧化氢的质量为x
2H2O2
2H2O+O2↑
68 32
x 0.8g
=
x=1.7g
该过氧化氢溶液的溶质质量分数
×100%=5%.
答:该过氧化氢溶液的溶质质量分数5%.
故填:0.8g;
(2)设参加反应的过氧化氢的质量为x
2H2O2
| ||
68 32
x 0.8g
| 68 |
| 32 |
| x |
| 0.8g |
x=1.7g
该过氧化氢溶液的溶质质量分数
| 1.7g |
| 34g |
答:该过氧化氢溶液的溶质质量分数5%.
点评:要想解答好这类题目,首先,要理解和熟记根据化学反应方程式的计算步骤和格式,以及与之相关的知识等.然后,根据所给的问题情景结合所学的相关知识和技能,细致地分析题意并细心地探究、推理后,按照题目要求进行认真地选择或解答即可.

练习册系列答案
相关题目
把碳酸钠粉末装入试管,正确的操作是( )
| A、用药匙或纸槽 | B、用镊子 |
| C、滴管 | D、玻璃棒 |
下列制取氧气的方法中,简单易行,不污染环境的是( )
A、高锰酸钾
| ||||
B、过氧化氢
| ||||
C、氯酸钾
| ||||
D、空气
|
 如图是一种家用电热水壶,看图回答下列问题.
如图是一种家用电热水壶,看图回答下列问题. 自制一个不使用电力的四轮小车(如图),往试管中加入化学试剂,塞紧塞子,让小车在摩擦力很小的水平道路上运动.
自制一个不使用电力的四轮小车(如图),往试管中加入化学试剂,塞紧塞子,让小车在摩擦力很小的水平道路上运动. 工业上用碳酸钠溶液与石灰水反应制烧碱,对于碳酸钠溶液与石灰水是否恰好完全反应,某化学兴趣小组的同学将其产物进行过滤,并对滤液进行如下探究.
工业上用碳酸钠溶液与石灰水反应制烧碱,对于碳酸钠溶液与石灰水是否恰好完全反应,某化学兴趣小组的同学将其产物进行过滤,并对滤液进行如下探究.